题目内容
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0(Q>0)
2SO3(g) ΔH<0(Q>0)
(1)写出该反应的化学平衡常数表达式:K=________.
(2)降低温度,该反应K值________,二氧化硫转化率________,化学反应速度________(以上均填“增大”、“减小”或“不变”).
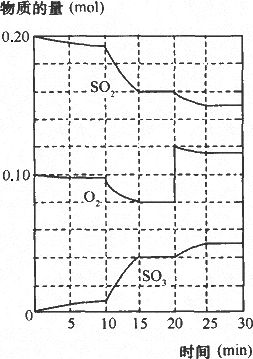
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是________.
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达),10 min到15 min的曲线变化的原因可能是________(填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
答案:
解析:
解析:
|
答案: (2)增大,增大,减小; (3)15~20 min和25~30 min; (4)增加了O2的量,ab 解析:反应处于平衡状态的标志是浓度随时间变化不变化,因此15分钟时达到平衡,反应进行至20 min时,氧气的浓度突然增加,二氧化硫和三氧化硫都从原浓度变化,因此改变的条件是增加氧气的浓度.10 min到15 min的曲线斜率变陡,反应速率增加变快,因此有a、b两种可能. |

练习册系列答案
相关题目
 近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )
近年来流行喝苹果醋.苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,其结构如图所示,下列相关说法正确的是( )| A、苹果酸在一定条件下能发生消去反应 | B、苹果酸在一定条件下能催化氧化生成醛 | C、苹果酸在一定条件下能发生加聚反应生成高分子化合物 | D、1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3 |




