题目内容
下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
(1)非金属性最强的元素是
(2)Ne 原子结构示意图为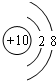
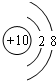 ;
;
(3)C 与N 中,原子半径较小的是
(4)氯水具有漂白作用,是由于其中含有
(5)元素最高价氧化物对应的水化物中,碱性最强的是
(6)元素硅的氧化物常用于制造
(7)如图为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表  碳原子),
碳原子),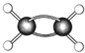 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | C | N | F | Na | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
F
F
;(2)Ne 原子结构示意图为
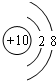
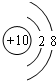
(3)C 与N 中,原子半径较小的是
N
N
;(4)氯水具有漂白作用,是由于其中含有
HClO
HClO
(填“HCl”或“HClO”)(5)元素最高价氧化物对应的水化物中,碱性最强的是
NaOH
NaOH
(填化学式),呈两性的是Al(OH)3
Al(OH)3
(填化学式);(6)元素硅的氧化物常用于制造
光导纤维
光导纤维
(填一种高性能的现代通讯材料的名称);(7)如图为某有机物的球棍模型(其中
 代表氢原子代表
代表氢原子代表  碳原子),
碳原子), 该有机物中碳元素与氢元素的质量比m(C):m(H)=
该有机物中碳元素与氢元素的质量比m(C):m(H)=6:1
6:1
.(相对原子质量C-12、H-l)(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
分析:同一周期中,元素的金属性随着原子序数的增大而减小,非金属性随着原子序数的增大而增大,同一周期中,元素的金属性随着原子序数的增大而增大,非金属性随着原子序数的增大而减小,根据元素所在周期表中的位置可知元素的种类,结合元素周期律知识判断元素、单质以及化合物的相关性质.
解答:解:(1)根据元素周期律知,位于元素周期表右上角的元素非金属性最强,所以这几种元素中,非金属性最强的是F元素,故答案为:F;
(2)Ne原子核外有10电子,其原子结构示意图为: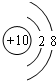 ,
,
故答案为: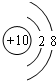 ;
;
(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,故答案为:N;
(4)氯水具有漂白性是因为氯水中含有次氯酸,故答案为:HClO;
(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,
故答案为:NaOH;Al(OH)3;
(6)二氧化硅常用于制造光导纤维,故答案为:光导纤维;
(7)根据其球棍模型知,该物质是C2H4,乙烯中m(C):m(H)=(12×2):(1×4)=6:1,
故答案为:6:1;
(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2
Mg+Cl2↑,
故答案为:MgCl2
Mg+Cl2↑.
(2)Ne原子核外有10电子,其原子结构示意图为:
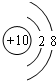 ,
,故答案为:
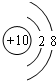 ;
;(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,故答案为:N;
(4)氯水具有漂白性是因为氯水中含有次氯酸,故答案为:HClO;
(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,
故答案为:NaOH;Al(OH)3;
(6)二氧化硅常用于制造光导纤维,故答案为:光导纤维;
(7)根据其球棍模型知,该物质是C2H4,乙烯中m(C):m(H)=(12×2):(1×4)=6:1,
故答案为:6:1;
(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2
| ||
故答案为:MgCl2
| ||
点评:本题考查元素周期表与元素周期律的知识,题目难度不大,注意周期律的递变规律,把握元素周期表的结构.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是