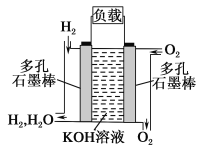
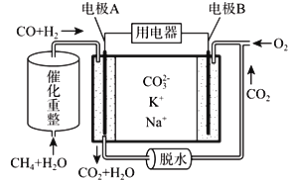
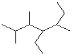
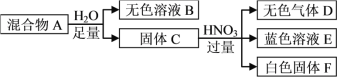��Ŀ����
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ�������ݣ��ݴ˻ش��й����⣺

��1����Ũ�������ʵ���Ũ��Ϊ________________��
��2��ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ����Ķ��ٶ��仯����_________(����ĸ���)��
a����Һ��H2SO4�����ʵ��� b����Һ��Ũ�� c����Һ���ܶ�
��3��ijͬѧ��������Ũ���������ˮ����500mL0.400mol��L��1��ϡ���ᡣ�ṩ�������У���ͷ�ιܡ����������ձ�����Ͳ��ϸ���Լ�ƿ��
������ϡ����ʱ����ȱ�ٵ�������_______________(д����)���������ϱ���_____(����ĸ���)��
a���¶� b��Ũ�� c������ d��ѹǿ e���̶���
�ڸ�ѧ����Ҫ��ȡ_________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿 (�ں�������д��ƫ��������ƫС��������Ӱ����)����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��__________________�����ݡ�ҡ�Ⱥ��ã�Һ����ڿ̶��ߣ�������ˮ���̶���________________��
���𰸡�18.4mol��L��1 bc 500mL����ƿ ace 10.9 ƫС ƫС
��������
��1������c=![]() ���㣻
���㣻
��2��������ȡ��Һ��Ũ�Ȳ�������жϣ�
��3���ٸ�������һ�����ʵ���Ũ�ȵ���Һ�IJ����ҳ�����Ҫ������
�ڸ���c1V1=c2V2�ɼ��㣻
�۸���c=![]() �ж�������Һ��Ũ����
�ж�������Һ��Ũ����
��1��Ũ��������ʵ���Ũ��c=![]() =18.4mol/L��
=18.4mol/L��
��2��a����Һ����������ʵ���=nV����������Һ������йأ�ѡ��a��ѡ��
b����Һ��Ũ��=c=![]() ������Һ������أ�ѡ��bѡ��
������Һ������أ�ѡ��bѡ��
c����Һ���ܶ�����Һ������أ�ѡ��cѡ��
��ѡbc��
��3��������500mL0.400mol��L��1��������Һ�����Ƹ���Һ�IJ����ǣ��������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ�ת�ơ����ݡ�ҡ�ȣ����ƹ�������Ҫʹ�õ�����Ϊ��ҩ�ס�������ƽ���ձ�����������500mL����ƿ����ͷ�ιܣ����Ի�ȱ�ٵ�����Ϊ��500mL����ƿ���������ϱ����¶ȡ��������̶��ߣ���ѡace��
�ڸ���c1V1=c2V2��֪18.4mol��L��1��V1=0.5L��0.400mol��L��1�����V1=0.0109L=10.9mL��
������Ͳ��ȡŨ����ʱ���Ӱ�Һ�棬��ȡ��Ũ����ƫ�٣����ʵ����ʵ���ƫС����Һ��Ũ��ƫС��
���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ��������Һ�����ƫ����Һ��Ũ��ƫС��

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�