题目内容
将Na和Na2O2的混合物12.4g投入足量水中,收集产生的气体并将其点燃,该混合气体恰好完全反应.
(1)求原混合物中Na与Na2O2的物质的量之比?
(2)如果反应后所得溶液体积为100 mL,则溶质物质的量浓度是多少?
答案:
解析:
提示:
解析:
|
(1)2∶1;(2)4mol·L-1 【巧解导析】(1)2Na+2H2O 4Na~2H2~O2~2Na2O2,所以n(Na)∶n(Na2O2) (2)Na~NaOH Na2O2~2NaOH 2n(Na2O2)×23+n(Na2O2)×7g=12.4 n(Na2O2)=0.1mol,n(Na)=0.2mol c(NaOH)= |
提示:
|
【巧解点悟】解题关键点:写出各步反应方程式,利用有关的(中间)物质,找出起始物与起始物、起始物与最终产物的量的关系式.易错点:易按各步反应进行计算而出错. |

练习册系列答案
相关题目
下列说法不正确的是( )
| A、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | B、向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变 | C、某醋酸稀溶液的pH=a,将此溶液稀释100倍后溶液的pH=b,则a+2>b | D、1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,共转移NA个电子 |
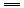 2NaOH+H2↑,2Na2O2+2H2O
2NaOH+H2↑,2Na2O2+2H2O 2H2O,物质间关系为:
2H2O,物质间关系为: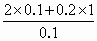 =4mol·L-1
=4mol·L-1