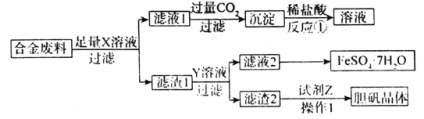
题目内容
【题目】磁性材料产业是21 世纪各国竞相发展的高科技支柱产业之一,碳酸锰(MnCO3)可制造电信器材的软磁铁氧体。工业上利用软锰矿(主要成分为 MnO2,含少量SiO2、Fe2O3、CuO 等杂质)和含SO2的烟气为主要原料制备无水碳酸锰的工艺流程如下:

已知:①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃ 时开始分解。
②不同金属离子生成氢氧化物沉淀的 pH 和有关物质的 Ksp 如下表:
离子 | Fe3+ | Fe2+ | Cu2+ | Mg2+ | ||||
开始沉淀的pH | 2.7 | 7.5 | 4.2 | 7.8 | ||||
沉淀完全的pH | 3.7 | 9.7 | 6.7 | 9.8 | ||||
物质 | MnS | CaF2 | CuS | |||||
Ksp | 2.5×10-13 | 1.5×10-10 | 1.3×10-36 | |||||
回答下列问题:
(1)为提高“溶浸”过程中的浸取速率,以下方法不能提高浸取速率的是________。
A.将矿石研磨粉碎 B.连续搅拌 C.延长浸取时间 D.升高温度 E.适当增大稀硫酸的浓度
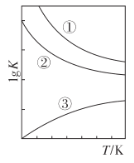
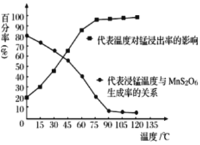
“溶浸”过程中往往有副产物MnS2O6 生成,温度对“溶浸”反应的影响如下图所示, 为减少MnS2O6的生成,“溶浸”的适宜温度应大于___。
(2)“除铁”步骤中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生反应的离子方程为____。
(3) “净化”步骤的目的是除去溶液中的Ca2+、Cu2+等杂质。若测得滤液中 c(F-)=0.02molL-1,则滤液中残留的c(Ca2+) =__。
(4) “沉锰”步骤中 ,加入 NH4HCO3后有无色无味的气体放出, 发生反应的离子方程式为______。
(5)从“沉锰”步骤中要得到纯净无水MnCO3,先将析出的 MnCO3沉淀过滤,再用_______(填化学式)洗涤更易于干燥。过滤后废液的主要成分为____(填化学式)。
(6)实际生产中, 运用阴离子交换膜法电解得到金属锰,电解装置如下图所示,B电极为直流电源的_________极。该工艺若不使用离子交换膜, 会造成Mn2+发生副反应生成 MnO2, 写出该副反应的电极反应式_______。

【答案】C 90℃ MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O 3.75×10-7 molL-1 Mn2+ + 2![]() = MnCO3 ↓+ CO2↑+ H2O C2H6O (NH4)2SO4 负极 Mn2++2H2O-2e-=MnO2+4H+
= MnCO3 ↓+ CO2↑+ H2O C2H6O (NH4)2SO4 负极 Mn2++2H2O-2e-=MnO2+4H+
【解析】
“溶浸”时,SiO2不溶于稀硫酸,通过过滤除去,所得溶液含H+、Mn2+、Fe2+、Cu2+、SO42-等离子;
“溶浸”所得溶液通过“除铁”将Fe3+转化为Fe(OH)3沉淀,然后过滤除去;
“除铁”后所得溶液通过“净化”将Ca2+、Cu2+转化为CaF2、CuS沉淀,然后过滤除去;
“净化”所得溶液主要含Mn2+、NH4+、SO42-,通过“沉锰”得到MnCO3,再经过滤、洗涤、烘干获得无水MnCO3,据此解答。
(1)A.将矿石研磨粉碎,可以增大反应物的接触面积,从而提高浸取速率,A不满足题意;
B.连续搅拌可以增大反应物的接触面积,从而提高浸取速率,B不满足题意;
C.延长浸取时间不能提高浸取速率,C满足题意;
D.升高温度可以加快反应速率,从而提高浸取速率,D不满足题意;
E.增大反应物的浓度,可以加快反应速率,从而提高浸取速率,E不满足题意;
由图可知,温度高于90℃,副产物MnS2O6的百分率低且随温度升高百分率几乎不再变化,故答案为:C;90℃;
(2)软锰矿的主要成分为MnO2,具有较强的氧化性,将“溶浸”所得的Fe2+氧化物Fe3+,发生反应的离子方程式为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O,故答案为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;
(3)Ksp(CaF2)=c(Ca2+)×c2(F-),所以c(Ca2+) =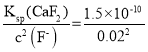 molL-1=3.75×10-7molL-1,故答案为:3.75×10-7molL-1;
molL-1=3.75×10-7molL-1,故答案为:3.75×10-7molL-1;
(4)“沉锰”时加入NH4HCO3后有无色无味的气体放出,根据元素守恒可知该气体为CO2,所以“沉锰”发生反应的离子方程式为Mn2++ 2![]() =MnCO3↓+ CO2↑+ H2O,故答案为:Mn2++ 2
=MnCO3↓+ CO2↑+ H2O,故答案为:Mn2++ 2![]() =MnCO3↓+ CO2↑+ H2O;
=MnCO3↓+ CO2↑+ H2O;
(5)MnCO3难溶于水和乙醇,潮湿时易被空气氧化,且乙醇易挥发,洗涤后更容易干燥,所以应用乙醇洗涤,乙醇化学式为C2H6O,整个流程来看,NH4+、SO42-未除去,所以过滤出MnCO3沉淀后废液主要成分为(NH4)2SO4,故答案为:C2H6O;(NH4)2SO4;
(6)由图可知,电解质溶液中的阴离子向左边电极移动,左边电极为阳极,A为电源的正极,B为电源的负极,结合电荷守恒可得Mn2+发生副反应的离子方程式为:Mn2++2H2O-2e-=MnO2+4H+,故答案为:负极;Mn2++2H2O-2e-=MnO2+4H+。