题目内容
纳米氧化镁具有特殊的热、光、电、力学和化学等性能,有广泛的应用前景。下图是利用海水制盐的副产品制备纳米氧化镁的流程图。
(1)操作I包括蒸发结晶、____________。
(2)操作I后得到的母液中镁离子浓度为1.8×10-3 mol·L-1,要使镁离子产生沉淀,溶液的pH最低应为_____________。(已知:Ksp[Mg(OH)2]= 1.8×10-11)
(3)反应I中CO(NH2)2与H2O反应生成CO2和NH3·H2O,还发生另一主要化学反应的离子方程式为______________________________。
(4)某科研小组研究反应I在378K~398K时的反应时问、反应物的物质的量配比等因素对制备纳米氧化镁产率的影响。请完成以下实验设计表:
| 实验 编号 | T/K | 反应 时间/h | 反应物的物质的量配比 n[CO(NH2)2]∶n[MgCl2?6H2O] | 实验目的 |
| ① | 378 | 3 | 3∶1 | (I)实验①和③探究探究反应物的物质的量配比对产率的影响; (II)实验②和④探究 ; (III)实验②和 探究反应时间对产 率的影响。 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | | |
| ④ | 398 | 4 | 4∶1 |
(5)下图为反应的温度对纳米MgO产率的影响。请归纳出温度对纳米MgO产率的影响规律________________________________。

(16分)
(1)过滤(2分)(写趁热过滤1分)
(2)10(3分)
(3)Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ (3分)
(4)③4∶1 (2分) (II)温度对产率的影响(2分) (III)③(1分)
(5)其他条件相同时,在376K~411K,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)(3分)
解析试题分析:(1)较高温度时NaCl等溶解度小于MgCl2等物质,联系海水晒盐推断,操作I包括蒸发结晶、过滤,滤渣主要成分是粗盐,滤液主要成分是MgCl2等;(2)由于Mg(OH)2(s) Mg2++2OH-,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH-),则c2(OH-)=
Mg2++2OH-,Ksp[Mg(OH)2]=c(Mg2+)?c2(OH-),则c2(OH-)=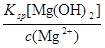 ,c(OH-)=
,c(OH-)= =
=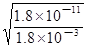 mol/L=1.0×10-4 mol/L;由于Kw= c(H+)?c(OH-),则c(H+)=
mol/L=1.0×10-4 mol/L;由于Kw= c(H+)?c(OH-),则c(H+)=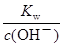 =
=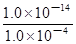 mol/L=1.0×10-10 mol/L;由于pH="—lg" c(H+)=10,则使镁离子开始沉淀的pH最小为10;(3)可溶性镁盐溶液与氨水反应可以制取氢氧化镁,该反应为Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ ;(4)(I)实验①和③探究探究反应物的物质的量配比对产率的影响,则实验①和③中其它条件都相同,只有反应物的物质的量配比不同,①中反应物的物质的量配比为3∶1,③中反应物的物质的量配比为4∶1;(II)实验②和④的其它条件相同,只有反应温度分别是378K、398K,则这组实验的目的是探究温度对产率的影响;(III)实验①和②的其它条件都相同,只有反应时间分别为3h、4h,因此该组实验的密度是探究反应时间对产率的影响;(5)读图,横坐标表示反应温度,纵坐标表示纳米MgO产率,在其它条件相同或不变时,在378K~411K之间,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)。
mol/L=1.0×10-10 mol/L;由于pH="—lg" c(H+)=10,则使镁离子开始沉淀的pH最小为10;(3)可溶性镁盐溶液与氨水反应可以制取氢氧化镁,该反应为Mg2++2NH3·H2O=Mg(OH)2↓ + 2NH4+ ;(4)(I)实验①和③探究探究反应物的物质的量配比对产率的影响,则实验①和③中其它条件都相同,只有反应物的物质的量配比不同,①中反应物的物质的量配比为3∶1,③中反应物的物质的量配比为4∶1;(II)实验②和④的其它条件相同,只有反应温度分别是378K、398K,则这组实验的目的是探究温度对产率的影响;(III)实验①和②的其它条件都相同,只有反应时间分别为3h、4h,因此该组实验的密度是探究反应时间对产率的影响;(5)读图,横坐标表示反应温度,纵坐标表示纳米MgO产率,在其它条件相同或不变时,在378K~411K之间,纳米MgO的产率随温度升高而升高,之后纳米MgO的产率随温度升高而降低(或其他条件相同时,纳米MgO的产率随温度的升高先升高后降低,或396K左右纳米MgO产率最高)。
考点:考查有关物质制备的化学工艺流程,涉及混合物分离提纯的操作方法、溶度积、水的离子积、溶液的pH、离子方程式、设计探究实验方案、根据图像规律温度对产率的影响规律等。

根据右图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理 (省略夹持、加热及净化装置),最合理的选项是
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硫酸 | 石灰石 | CO2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
下列反应适用于实验室制备氧气的是
①高锰酸钾热分解 2KMnO4 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑
②硝酸铵热分解 2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③过氧化氢催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮热分解 2NO2 2NO+ O2↑
2NO+ O2↑
| A.只有① | B.①和② | C.①和③ | D.①③④ |
化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知:
| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液

②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |


 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:



 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O