题目内容
13.根据总反应式:Zn+Cu2+=Zn2++Cu,请分析下述原电池的组成,对应正确的一组是( )| A | B | C | D | |
| 正极 | Cu | Cu | Zn | Ag |
| 负极 | Zn | Zn | Cu | Cu |
| 电解质溶液 | CuSO4 | AgNO3 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
分析 电池反应式中Zn化合价由0价变为+2价、Cu元素化合价由+2价变为0价,则Zn作负极、不如锌活泼的金属或导电的非金属作正极,电解质溶液为可溶性的铜盐.
解答 解:电池反应式中Zn化合价由0价变为+2价、Cu元素化合价由+2价变为0价,则Zn作负极、不如锌活泼的金属或导电的非金属作正极,电解质溶液为可溶性的铜盐.
A.Zn作负极、Cu作正极、硫酸铜作电解质,符合条件,故A正确;
B.电解质为可溶性的铜盐,不能为硝酸银,故B错误;
C.锌作负极、铜作正极,该装置不符合条件,故C错误;
D.锌作负极,该装置不符合条件,故D错误;
故选A.
点评 本题考查了原电池原理,根据元素化合价变化来确定正负极和电解质溶液,再结合题给选项来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
4.以下说法正确的是( )
| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
1.下列各组离子在给定条件下能大量共存的是( )
| A. | 强酸性溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 在强碱性的溶液中:NH4+、Na+、Cl-、H+ |
8.下列粒子半径比较中,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | O2->S2->Cl->Br- | D. | F->Li+>Na+>S2- |
18.某烃结构简式如图: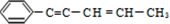 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )
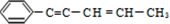 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 所有原子不可能在同一条直线上 | ||
| C. | 所有碳原子可能在同一平面上 | D. | 该烃属于苯的同系物 |
5.有机物的命名是有规则的,下列有机物用系统命名法命名正确的是( )
| A. | 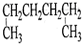 1,4-二甲基丁烷 | B. | 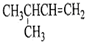 3-甲基丁烯 | C. | 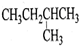 2-甲基丁烷 | D. | 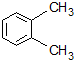 邻二甲苯 |
3.1989年,IUPAC(国际纯粹与应用化学联合会)建议用1~18列替代原主族、副族等.下列有关说法错误的是( )
| A. | 元素周期表中第3列的元素种类数最多 | |
| B. | 金属性最强的元素位于元素周期表的第1列 | |
| C. | 非金属性最强的元素位于元素周期表的第17列 | |
| D. | 能形成化合物的种类数最多的元素位于元素周期表的第16列 |