题目内容
19.某淡黄色粉末A在加热的条件下可与某金属B反应生成金黄色的固体化合物C(黄铁矿主要成分),A又能在空气中燃烧生成无色有刺激性气味的气体D,向足量D的饱和溶液中通入0.1mol气体E,产生4.8gA.请你回答:
(1)写出气体E的电子式
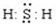
(2)写出化合物C在足量的氧气中点燃的化学反应方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
(3)固体C在氧气燃烧的气体产物通入一定量的FeCl3溶液中,该反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,并设计实验检验所得到的溶液中是否含有Fe2+取少量所得溶液,加入适量高锰酸钾溶液,若溶液褪色则说明含有Fe2,反之则不含有.
分析 为淡黄色粉末是一特征信息,是解题的突破口,常见只有过氧化钠、单质硫两种,A又能在空气中燃烧生成无色有刺激性气味的气体D,能燃烧说明是硫,D为SO2,向足量D饱和溶液中通入0.1mol气体E生成4.8gA,n(S)=$\frac{4.8g}{32g/mol}$=0.15mol,二氧化硫生成硫,硫元素化合价降低,则E元素化合价升高,说明E为H2S,金黄色的固体是黄铁矿主要成分为硫化亚铁,
(1)气体E为H2S为共价化合物,形成的是共用电子对;
(2)化合物C为FeS2,在足量的氧气中点燃燃烧反应生成二氧化硫和氧化铁;
(3)FeS2在足量的氧气中点燃燃烧反应生成二氧化硫和氧化铁,生成的气体二氧化硫具有还原性,通入一定量的FeCl3溶液中发生氧化还原反应生成氯化亚铁和硫酸,依据亚铁离子具有还原性设计实验验证.
解答 解:为淡黄色粉末是一特征信息,是解题的突破口,常见只有过氧化钠、单质硫两种,A又能在空气中燃烧生成无色有刺激性气味的气体D,能燃烧说明是硫,D为SO2,向足量D饱和溶液中通入0.1mol气体E生成4.8gA,n(S)=$\frac{4.8g}{32g/mol}$=0.15mol,二氧化硫生成硫,硫元素化合价降低,则E元素化合价升高,说明E为H2S,金黄色的固体是黄铁矿主要成分为硫化亚铁,
(1)气体E为H2S,硫原子和氢原子间形成两对共用电子对.硫化氢的电子式为: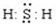 ,
,
故答案为: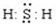 ;
;
(2)化合物C为FeS2,在足量的氧气中点燃燃烧反应生成二氧化硫和氧化铁,反应的化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(3)FeS2在足量的氧气中点燃燃烧反应生成二氧化硫和氧化铁,生成的气体二氧化硫具有还原性,通入一定量的FeCl3溶液中发生氧化还原反应生成氯化亚铁和硫酸,反应的离子方程式为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,亚铁离子具有还原性设计实验验证,取少量所得溶液.加入适量高锰酸钾溶液,若溶液褪色则说明含有Fe2+.反之则不含有,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;取少量所得溶液,加入适量高锰酸钾溶液,若溶液褪色则说明含有Fe2+,反之则不含有.
点评 本题考查了无机物转化关系、物质性质、电子式、化学方程式、离子检验等知识点,主要是硫及其化合物性质的分析应用,掌握基础是解题关键,题目难度不大.

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | 氢氧化铁胶体中的铁离子和氯离子可用渗析法除去 | |
| B. | 硬脂酸钠中混有少量的甘油,用盐析法除去 | |
| C. | 乙酸乙酯中混有少量乙酸,用饱和碳酸钠溶液洗涤后分液 | |
| D. | 氯化钠中有少量氯化铵,加过量的烧碱溶液后加热蒸干 |
| A. | Cl2 | B. | NH3 | C. | NO2 | D. | SO2 |
| A. | 把不锈钢牙都换成铝质假牙 | B. | 把金质假牙换成铝质假牙 | ||
| C. | 把不锈钢假牙换成金质假牙 | D. | 在不锈钢假牙表面镀上一层金 |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
主要化合价 | 最高 正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低 负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | H2Q的还原性和稳定性大于RH3 | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM,YM都是电解质,熔融状态下都能电解 | |
| D. | 元素Z、M组成的化合物熔化时破坏了离子键 |
| A. | 糖类、脂肪和蛋白质都能发生水解反应 | |
| B. | 浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 | |
| C. | 淀粉与纤维素最终的水解产物相同 | |
| D. | 葡萄糖与新制Cu(OH)2悬浊液加热至沸腾能生成红色沉淀 |
| A. | 铁与氯气反应 | B. | CO通过灼热的三氧化二铁 | ||
| C. | 向氯化亚铁溶液中滴加双氧水 | D. | 铁与盐酸反应 |
| A. | 碳酸氢钙溶液和氢氧化钠 | B. | 碳酸钠溶液和硫酸 | ||
| C. | 偏铝酸钠溶液和氢氧化钠 | D. | 硫酸氢钠溶液和氯化钡溶液 |
| A. | CO和N2 | B. | N2H4和 C2H4 | C. | CO2和N2O | D. | O3和SO2 |