题目内容
【题目】(I)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
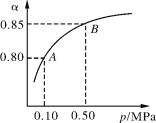
(1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式)
(2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2
D.接触室中压强不随时间变化而变化
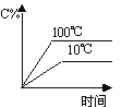
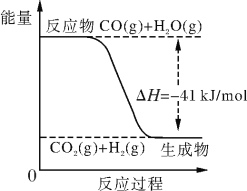
(II)已知工业制氢气的反应为CO(g)+H2O(g) CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。
(6)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。
【答案】800 = AD 增大 ![]() > 2CO(g)+O2(g)2CO2(g)△H=566kJ/mol
> 2CO(g)+O2(g)2CO2(g)△H=566kJ/mol
【解析】
(I)(1)反应达平衡后,体系总压强为0.10MPa,由图可知,SO2的平衡转化率α=0.80,利用三段式表示出平衡时反应混合物各组分的物质的量,再计算平衡时反应混合物各组分的平衡浓度,代入平衡常数表达式计算;
(2)平衡状态由A变到B时,改变的是压强,平衡常数只受温度影响,温度不变,平衡常数不变;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,据此判断;
(II)(4)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(5)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(6)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得。
(I)(1)反应达平衡后,体系总压强为0.10MPa,由图可知,此时SO2的平衡转化率α=0.80,则参加反应的二氧化硫为2mol×80%=1.6mol,可列三段式:

所以平衡时浓度:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,故平衡常数![]() ;
;
故答案为:800;
(2)平衡状态由A变到B时,改变的是压强,平衡常数只受温度影响,温度不变,平衡常数不变,故平衡常数K(A)=K(B);
故答案为:=;
(3)A. 气体的总质量不变,随反应进行,气体的物质的量减小,平均相对分子质量增大,平均相对分子质量不变,说明到达平衡状态,故A正确;
B. 平衡时接触室中SO2、O2的浓度一定不相同,开始物质的量为2:1,按2:1反应,平衡时二者的物质的量之比为2:1,浓度之比为2:1,故B错误;
C. 平衡时接触室中SO2、O2、SO3物质的量之比可能为2:1:2,可能不是2:1:2,与二氧化硫的转化率有关,故C错误;
D. 随反应进行,气体的物质的量减小,接触室中压强减小,压强不随时间变化而变化,说明到达平衡状态,故D正确.
故答案为:AD;
(II)(4)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
故答案为:增大;
(5)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,则![]() ;从图上可见反应放热,降温平衡正向移动,K增大;
;从图上可见反应放热,降温平衡正向移动,K增大;
故答案为:![]() ;>;
;>;
(6)已知:①CO(g)+H2O(g)CO2(g)+H2(g) △H=41kJ/mol;
②2H2(g)+O2(g)2H2O(g) △H= 484kJ/mol;
根据盖斯定律①×2+②得:2CO(g)+O2(g)2CO2(g) △H=566kJ/mol;
故答案为:2CO(g)+O2(g)2CO2(g) △H=566kJ/mol。