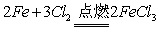题目内容
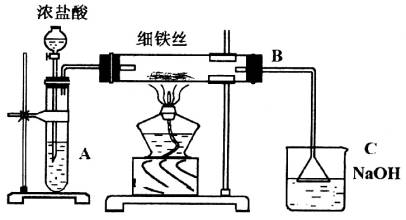
如下图所示,将浓盐酸滴加到高锰酸钾晶体上。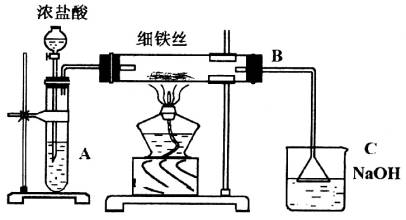
(1)装置A中发生反应的化学方程式为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
装置A中看到的现象是________。
由方程式可见反应前锰元素的化合价是________;反应后锰元素的化合价是________反应后生成的氯气中,氯元素化合价是________,生成的二氯化锰和氯化钾中氯元素的化合价是________,由此可见,氯元素部分被氧化16个氯化氢分子中只有________个发生了氧化反应。如果参加反应的氯化氢是146 g,那么被氧化的氯化氢是________g。
(2)装置B中的现象是________,反应的化学方程式是________________________。
(3)装置C中的作用是________反应的化学方程式是________________________。
答案:
解析:
解析:
| (1)生成黄绿色气体;+7价;+2价,零价;-1价;10个;91.25g
(2)铁丝燃烧,生成棕色的烟; (3)吸收余氯;C12+2NaOH=NaCl+NaClO+H2O。
|

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是
| 选项 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
| C | 石蕊溶液先变红后褪色 | Cl2具有漂白性 |
| D | KI-淀粉溶液变蓝 | Cl2具有氧化性 |
已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

|
选项 |
实验现象 |
结论 |
|
A |
滴有KSCN的FeCl2溶液变红 |
Cl2具有还原性 |
|
B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
|
C |
石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
|
D |
KI-淀粉溶液变蓝 |
Cl2具有氧化性 |