题目内容
根据反应(1) ;(2)
;(2) 可判断离子的还原性由强到弱的顺序正确的是
可判断离子的还原性由强到弱的顺序正确的是
[ ]
A.

B.

C.

D.

答案:B
解析:
解析:
|
可根据“在同一氧化还原反应中,还原剂的还原能力强于还原物的还原能力”的规律来分析. 根据反应 (1)得还原性 ,根据反应(2)得还原性 ,根据反应(2)得还原性 综合得出还原性强弱的顺序为 综合得出还原性强弱的顺序为 |

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验。按右表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象。
| 实验 | P2O5 | 95%乙醇量 | 加热方式 |
| 实验1 | 2g | 4mL | 酒精灯 |
| 实验2 | 2g | 4mL | 水浴70℃ |

实验结果如下:
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
(1)写出乙醇制乙烯的化学方程式 。
(2)上图装置中冷凝管的作用是___________,进水口为(填“a”或“b”)______,浓硫酸的作用是 。
(3)实验1使溴的四氯化碳溶液褪色的物质是___________。
(4)实验2中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外)。
(5)三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式
_____________________,P2O5在实验1中的作用是______________________ 。
(6)根据实验1、2可以推断:
①以P2O5作为催化剂获得乙烯的反应条件是____________
②P2O5与95%乙醇在加热条件下可以发生的有机反应的类型是________反应。
(7分)控制变量法是研究化学变化规律的重要思想方法,请仔细观察表中100mL稀盐酸和2g Zn反应的实验数据:
|
实验序 号 |
锌的 状态 |
C(HCl) mol/L |
溶液温度 ℃ |
锌消失时间(s) |
|
|
反应前 |
反应后 |
||||
|
1 |
粒状 |
0.5 |
20 |
39 |
400 |
|
2 |
粒状 |
0.6 |
20 |
41 |
310 |
|
3 |
粉末 |
0.5 |
20 |
40 |
280 |
|
4 |
粒状 |
0.8 |
20 |
40 |
200 |
|
5 |
粉末 |
0.8 |
20 |
40 |
30 |
|
6 |
粒状 |
1.0 |
20 |
40 |
120 |
|
7 |
粒状 |
1.0 |
30 |
50 |
40 |
|
8 |
粒状 |
1.2 |
20 |
40 |
90 |
|
9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于 反应(填“吸热”或“放热”)。
(2)实验6和7表明: 对反应速率有影响, 反应速率越快,能表明同一规律的还有 (填实验序号);
(3)根据实验1、2、4、6、8可以得出的条件对反应速率的影响规律是: ;
(4)本实验中影响反应速率的其他因素还有 ,能表明这一规律的实验序号是1、3与 。
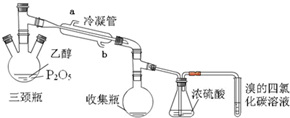 有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象.
有学生用五氧化二磷作为乙醇脱水制乙烯的催化剂,进行相关实验.按表所示的量和反应条件在三颈瓶中加入一定量P2O5,并注入95%的乙醇,并加热,观察现象. ;(2)
;(2) 可判断离子的还原性由强到弱的顺序正确的是
可判断离子的还原性由强到弱的顺序正确的是


