题目内容
把2.0mol?L-1 CuSO4溶液和1.0mol?L-1H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和).计算:
(1)混合液中Cu2+的物质的量浓度 ;
(2)向溶液中加入足量铁粉,经充分反应后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度 .
(1)混合液中Cu2+的物质的量浓度
(2)向溶液中加入足量铁粉,经充分反应后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度
考点:有关混合物反应的计算
专题:计算题
分析:(1)根据稀释定律,稀释前后Cu2+的物质的量不变,据此计算混合溶液中c(Cu2+);
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-),
根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4、H2SO4的物质的量浓度,溶液中硫酸根来源于硫酸铁与硫酸电离,故溶液中 c(SO42-)=c(CuSO4)+c(H2SO4).
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-),
根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4、H2SO4的物质的量浓度,溶液中硫酸根来源于硫酸铁与硫酸电离,故溶液中 c(SO42-)=c(CuSO4)+c(H2SO4).
解答:
解:(1)根据稀释定律,稀释前后Cu2+的物质的量不变,则混合溶液中c(Cu2+)=
c(CuSO4)=
×2.0mol/L=1mol/L,故答案为:1mol/L;
(2)2.0mol?L-1 CuSO4溶液和1.0mol?L-1H2SO4等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=
×2.0mol/L=1.0 mol/L,c(H2SO4)=
×1.0mol/L=0.5mol/L,
溶液中硫酸根来源于硫酸铁与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故答案为:1.5mol/L.
| 1 |
| 2 |
| 1 |
| 2 |
(2)2.0mol?L-1 CuSO4溶液和1.0mol?L-1H2SO4等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=
| 1 |
| 2 |
| 1 |
| 2 |
溶液中硫酸根来源于硫酸铁与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铁、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故答案为:1.5mol/L.
点评:本题考查物质的量浓度的有关计算,比较基础,注意对稀释定律理解与灵活应用,(2)中注意利用守恒法解答,简化计算过程.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列有关物质检验的说法中正确的是( )
| A、鉴别Na2CO3溶液和NaHCO3溶液常用的试剂是澄清石灰水 |
| B、(NH4)2SO4、K2SO4、NH4Cl三种物质不能用一种试剂通过化学反应区别开 |
| C、可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质 |
| D、用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
用铂电极电解下列溶液时,阴极和阳极的主要产物分别为H2和O2的是( )
| A、稀NaOH溶液 |
| B、HCl溶液 |
| C、CuCl2溶液 |
| D、酸性AgNO3溶液 |
下列化合物中,不能发生消去反应的是( )
| A、CH3CH2OH |
| B、CH3CH2Cl |
| C、(CH3)2CHBr |
| D、(CH3)3C-CH2Br |
工业上常用稀硫酸清洗铁制品表面的锈层,这是利用硫酸的( )
| A、酸性 | B、吸水性 |
| C、强氧化性 | D、不挥发性 |


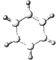
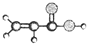
 分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途.