题目内容
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物。(1)W在元素周期表中的位置是__________,Z2Y的电子式是_________。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是______。
a.升高温度 b.加入催化剂 c.将XQ3及时分离出去 d.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是____________。
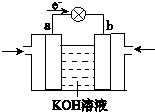
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是________。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是______。
a.升高温度 b.加入催化剂 c.将XQ3及时分离出去 d.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是____________。
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是________。

(5)已知:
W(s)+ Y2(g)= WY2(g) ΔH=-393.5 kJ/mol
WY(g)+ Y2(g)= WY2(g) ΔH=-283.0 kJ/mol
24 g W与一定量的Y2反应,放出热量362.5 kJ,所得产物的物质的量之比是__________。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是_______________。
W(s)+ Y2(g)= WY2(g) ΔH=-393.5 kJ/mol
WY(g)+ Y2(g)= WY2(g) ΔH=-283.0 kJ/mol
24 g W与一定量的Y2反应,放出热量362.5 kJ,所得产物的物质的量之比是__________。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是_______________。
(1)第二周期IVA族;
(2)d
(3)c(NO3-)>c(H+)>c(NH4+)>c(OH-)
(4)CH3OH-6e-+ 8OH-=CO32-+ 6H2O
(5)n(CO2)∶n(CO)=1∶3
(6)Na3N + 4H2O=3NaOH + NH3·H2O

(2)d
(3)c(NO3-)>c(H+)>c(NH4+)>c(OH-)
(4)CH3OH-6e-+ 8OH-=CO32-+ 6H2O
(5)n(CO2)∶n(CO)=1∶3
(6)Na3N + 4H2O=3NaOH + NH3·H2O

练习册系列答案
相关题目
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
| A、氢化物稳定性:Z>W | B、原子半径的大小顺序:rX>rY>rQ>rW | C、元素Q和Z能形成QZ2型的共价化合物 | D、X、Y的最高价氧化物的水化物之间不能发生反应 |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
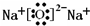
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.