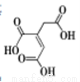
题目内容
12.过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O
(2)Na2O2、K2O2、以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得.最适合的过氧化物是
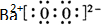 (写电子式),
(写电子式),(3)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:KI+O3+H2O→KOH+I2+O2(未配平 )回答问题:①还原产物的化学式为KOH
②配平后的化学方程式是2KI+O3+H2O=2KOH+I2+O2.
分析 (1)酸性溶液中过氧化氢具有氧化性,能氧化氯化亚铁为氯化铁,过氧化氢被还原为水;
(2)根据题目信息,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了沉淀;
(3)①反应中碘化钾是还原剂,臭氧作氧化剂得电子发生还原反应,反应中得电子化合价降低的物质是氧化剂,氧化剂对应的产物是还原产物;
②依据元素化合价变化结合电子守恒配平书写化学方程式;
解答 解:(1)酸性条件下H2O2氧化氯化亚铁生成氯化铁和水,反应的离子方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O;
故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为: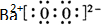 故答案为:
故答案为: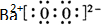 ;
;
(3)该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物,碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为:2KI+O3+H2O=2KOH+I2+O2;
故答案为:KOH;2KI+O3+H2O=2KOH+I2+O2;
点评 本题考查了氧化还原反应的产物判断、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

练习册系列答案
相关题目
2.化学式为C3H7FO的物质,含有羟基的同分异构体数目为(不考虑空间异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
3.下列有关图示分析正确的是( )
| A. |  如图所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 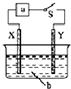 如图所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | 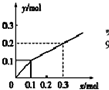 Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图,离子氧化能力M+>N3+>H+ | |
| D. | 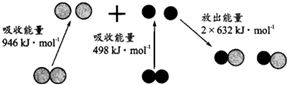 如图为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
20.我省近年来以铁矿石为原料的产业发展迅猛,下列有关说法正确的是( )
| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
7.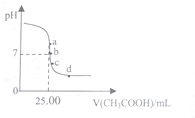 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )| A. | a点:c(CH3COONa)=0.1000 mol•L-1 | B. | b点:c(CH3COONa)=c(CH3COOH) | ||
| C. | c点:c(H+)=c(CH3COO-)+c(CH3COOH) | D. | d点:c(Na+)<c(CH3COO-)+c(CH3COOH) |
8.合乎实际并用于工业生产的是( )
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。