题目内容
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)?H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
| A.25% | B.50% | C.75% | D.80% |
依据化学平衡,设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) X X X X
平衡量(mol/L) 0.02-X 0.02-X X X
平衡常数K=
=
=9
解得:X=0.015mol/L;
一氧化碳转化率=
×100%=75%
故选C.
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) X X X X
平衡量(mol/L) 0.02-X 0.02-X X X
平衡常数K=
| C(H2)C(CO2) |
| C(CO)C(H2O) |
| X2 |
| (0,02-X)2 |
解得:X=0.015mol/L;
一氧化碳转化率=
| 0.015mol/L |
| 0.02mol/L |
故选C.

练习册系列答案
相关题目
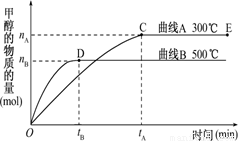
 CH3OH(g).
CH3OH(g).
 式K= ,
式K= , 温度,K值 (填“增大”“减小”或“不变”)
温度,K值 (填“增大”“减小”或“不变”) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移 CH3OH(g).
CH3OH(g).