题目内容
10. 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )| A. | 在氢能的利用过程中,H2O可循环使用 | |
| B. | 开发和利用“氢能”,减少煤炭等化石能源的使用有助于控制臭氧空洞的形成 | |
| C. | 该法制氢的关键是寻找光分解催化剂 | |
| D. | 利用光电转化可将太阳能转化为电能用于电解水而获得氢气 |
分析 A.根据图示可知,水在转化过程中可以循环利用;
B.减少化石燃料的使用,可以减少二氧化碳的排放,有助于控制温室效应和属于的形成;
C.水在太阳能、光分解催化剂作用下分解生成氢气和,关键是缺少合适的光分解催化剂;
D.根据图示,将光能转化成了电能,有了充足、廉价的电能,可通过分解水可以获得大量的氢气.
解答 解:A.由图示可知,水分解生成氢气和氧气,氢气和氧气形成燃料电池产生电能,同时生成水,所以水可以循环利用,故A正确;
B.开发和利用“氢能”,减少煤炭等化石能源的使用,大大减少了二氧化碳、二氧化硫的产生,有利于控制酸雨和温室效应,而臭氧层空洞与氟利昂有关,与化石燃料无关,故B错误;
C.根据图示可知,水在太阳能、光分解催化剂作用下分解生成氢气和氧气,关键是寻找合适的催化剂,故C正确;
D.实现了图示转化后,将太阳能转化成了廉价的电能,然后可利用电解水获得大量的氢气,故D正确;
故选B.
点评 本题考查了能源的开发与利用,题目难度中等,注意掌握常见能源类型及转化关系,明确化学在开发利用新能源中的重要作用,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
20.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状) | 酸的浓度及体积 | 反应温度 | |
| A | Mg 0.1g | 18.4mol•L-1硫酸10mL | 80℃ |
| B | Mg 0.1g | 1.5mol•L-1盐酸10mL | 60℃ |
| C | Fe 0.1g | 1mol•L-1盐酸 10mL | 60℃ |
| D | Mg 0.1g | 1mol•L-1硫酸10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
1.下列反应中,不能生成Al(OH)3沉淀的是( )
| A. | 氧化铝和水 | B. | 三氯化铝和氨水 | ||
| C. | 氧化铝和强碱溶液 | D. | 铝和强碱溶液 |
5.下列除去杂质的方法可行的是( )
| A. | 除去二氧化碳中混有的少量一氧化碳气体,通入过量氧气并点燃 | |
| B. | 除去碳酸氢钠固体中少量的碳酸钠固体,用加热法 | |
| C. | 除去CO2中少量的HCl:将气体通过盛饱和烧碱溶液的洗气瓶 | |
| D. | 除去铁中混有的少量铝,将固体投入足量NaOH溶液经充分反应后过滤 |
15.下列叙述正确的是:( )
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用99%的乙醇溶液进行消毒
③光导纤维的主要成分是二氧化硅
④氢氧化铁胶体具有杀菌净水作用
⑤碳酸钠、氢氧化钠、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥可以用二氧化硅和水反应制备硅酸胶体.
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用99%的乙醇溶液进行消毒
③光导纤维的主要成分是二氧化硅
④氢氧化铁胶体具有杀菌净水作用
⑤碳酸钠、氢氧化钠、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥可以用二氧化硅和水反应制备硅酸胶体.
| A. | ②③④ | B. | ①③ | C. | ①②④ | D. | ①③⑥ |
2.下列关于各实验装置图的叙述中,正确的是( )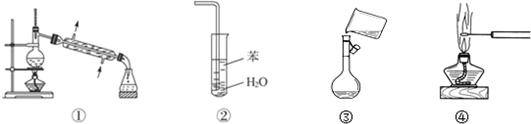

| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收NH3,并防止倒吸 | |
| C. | 图③是将溶解好的溶液转移到容量瓶中 | |
| D. | 图④可观察NaCl的焰色反应 |
19.有钠、镁、铝各n mol,分别与等体积、均与含xmolHCl的盐酸反应,下列说法不正确的是( )
| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
14.X、Y是元素周期表中同一周期的两种元素,下列叙述能说明X的原子失电子能力比Y强的是( )
| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |