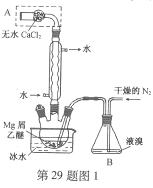
题目内容
【题目】【2016届临沂一模】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
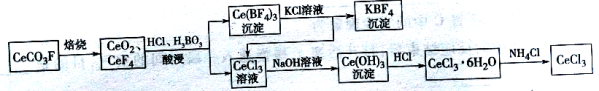
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式: 。
(3)向Ce(BF4)3中加入KCl溶液的目的是 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的pH为 。
(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3 .6H2O和NH4Cl的固体混合物可得到无水CeCl3 ,其中NH4Cl的作用是____________。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=Ce3++Fe3+)
①该样品中CeCl3的质量分数为 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数 (填“偏大”、“偏小”或“无影响”)
【答案】(1)+3 (1分)(2)H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑(2分,化学式写错、不配不得分,写化学方程式不得分)
(3)避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4-或提高CeCl3的产率
(2分,合理答案均得分)(4)9(2分)
(5)NH4Cl固体受热分解产生HCl,抑制CeCl3水解(2分,合理答案均得分)
(6)①82.2%或82.17% (2分) ②偏大(2分)
【解析】
试题分析:(1)CeCO3F中,CO32-是负二价,氟是负一价,则Ce元素的化合价为+3价;
(2)稀硫酸、H2O2与CeO2反应的离子方程式H2O2+2CeO2+6H+=2Ce3++4H2O+O2↑;
(3)避免三价铈以Ce(BF4)3沉淀的形式损失,应向Ce(BF4)3中加入KCl溶液;
(4)溶液中的c(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,则KSP[Ce(OH)3]=1×10-20= c(Ce3+)c3(OH-)=1×10-5×c3(OH-),c(OH-)=10-5 mol·L-1,则c(H+)=10-9 mol·L-1,此时溶液的PH为9;
(5)加热CeCl3·6H2O得到无水CeCl3 ,加入了NH4Cl固体,因为NH4Cl固体受热分解产生HCl,可抑制CeCl3水解;
(6)①根据反应Fe2++Ce4+= Ce3++Fe3+及Fe2+的物质的量0.025×0.1=0.0025mol,得Ce3+的物质的量是0.0025mol,则样品中CeCl3的质量分数为(0.0025×246.5/0.75)×100%=82.2%;
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,亚铁离子有可能被氧化,将会导致标准液体积偏大,CeCl3样品的质量分数将偏大。

 阅读快车系列答案
阅读快车系列答案【题目】【2016届天津河东区二模】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):_____________、____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(4)一定条件下,在水溶液中1 mol E-、EOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。

(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)。