题目内容
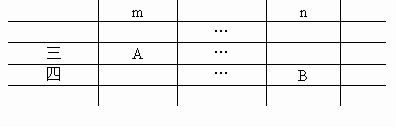
位于周期表第三、四周期的主族元素A和B,它们的离子相差两个电子层.已知A元素位于元素周期表中第m主族,B元素位于第n主族,那么:
(1)A元素原子的核外电子数为(用含m的代数式表示)________,其离子最外层电子数为
________.
(2)B元素原子的核内质子数为(用含n的代数式表示)________,其离子的电子数为________.
答案:10+m,8$m+10,8;28+n,36$n+28,36
解析:
解析:
|
本题解答的关键是首先搞清楚 A、B两元素在元素周期表中的相对位置.由我们平时所学离子与电子层结构的关系可知,金属元素的简单阳离子与该元素的上一周期的稀有气体元素原子的电子层结构相同,非金属元素的简单阴离子与该元素的同一周期的稀有气体元素原子的电子层结构相同.现A、B两元素相差一个周期,即它们的原子相差一个电子层,而它们的离子相差两个电子层.说明A、B两元素中有一个元素处于第三周期左边金属元素的位置,另一元素应为第四周期右边非金属元素,其位置草图如下:
(1) 因此,对于第三周期第m主族的金属元素A来讲,其原子的核外电子数为10+m,形成离子时,最外层电子数为8.(2) 处于第四周期第n主族的非金属元素B,其原子的核外电子数为18+10+n=28+n,形成离子的电子数为28+8=36. |

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案
相关题目
[s1] X、Y、Z、M是周期表前四周期中的四种常见元素,原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| X | 原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为 |
| Z | 与Y同周期,第一电离能小于Y |
| M | 与X形成的合金为目前用量最多的金属材料 |
(1)Z位于周期表第 周期第 族。Y、Z的氢化物稳定性较强的是 (写化学式)。
(2)X与氢可形成一种原子个数比为1:1的化合物,相对分子质量为78,该分子中存在 个![]() 键。H—X、H—Y、H—Z三种共价键中,键长最长的是 。
键。H—X、H—Y、H—Z三种共价键中,键长最长的是 。
(3)M元素基态原子的电子排布式是 。
(4)已知下列数据:
 M(s)+
M(s)+![]() Z2(g) MZ(s) △H=-272.kJ·mol-1
Z2(g) MZ(s) △H=-272.kJ·mol-1
 2M(s)+
2M(s)+![]() Z2(g) M2Z3(s) △H=-824.2.kJ·mol-1
Z2(g) M2Z3(s) △H=-824.2.kJ·mol-1
MZ转化为M2Z3的热化学方程式是
[s1]18.
 ,
, ,
,
 MZ(s):△H= -272 kJ/mol
MZ(s):△H= -272 kJ/mol M2Z3(s) △H=-824.2 kJ/mol
M2Z3(s) △H=-824.2 kJ/mol