题目内容
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向 。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是 。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+ 。
(1)V2O5 +K2SO3+2H2SO4→2VOSO4+K2SO4+2H2O (2分)
(写成离子方程式也给分 V2O5 + SO32–+4H+→2VO2++ SO42–+2H2O )
(2) (配平1分,电子转移的数目及方向1分)
(配平1分,电子转移的数目及方向1分)
(3)b(2分)
(4)Cl2+ SO32–+ H2O→2Cl–+ 2H++ SO42–(2分)
解析试题分析:(1)由题意可知,V2O5与稀硫酸、亚硫酸钾反应生成VOSO4、K2SO4,根据原子守恒可知还生成H2O。其中V的化合价从+5价降低到+4价,得到1个电子。亚硫酸钾中S元素的化合价从+4价升高到+6价,失去2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:1,所以配平后方程式为V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O。
(2)ClO3-与VO2+反应生成VO2+、Cl-,氯元素化合价由+5价降低为-1价,共降低6价。V元素化合价由+4升高为+5价,共升高1价,化合价升降最小公倍数为6,故ClO3-的系数为1、VO2+系数为6,由原子守恒可知成VO2+的系数为6,Cl-的系数为1,由电荷守恒可知还生成H+,系数为6,故有水参加反应,系数为3,因此配平该反应的离子方程式,并标出电子转移的数目和方向为 。
。
(3)0.195g锌粉的物质的量=0.195g÷65g/mol=0.003mol,设V元素在还原产物中的化合价为a,则根据电子得失守恒可知0.003×2=0.02L×0.1mol/L×(5-a),解得a=2,答案选b。
(4)在氧化还原反应中还原剂的还原性强于还原产物的,V2O5能和盐酸反应生成氯气和VO2+,故还原性Cl->VO2+,氯气可以将亚硫酸根氧化生成硫酸根、自身被还原为Cl-,可以说明还原性SO32->Cl-,反应离子方程式为Cl2+SO32-+H2O=2Cl-+2H++SO42-。
考点:考查氧化还原反应的有关判断、配平和计算等

 期末集结号系列答案
期末集结号系列答案欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
| A.随时将CH3OH与反应混合物分离 | B.降低反应温度 |
| C.增大体系压强 | D.使用高效催化剂 |
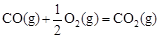 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1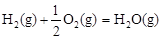 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
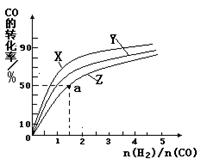
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)
 CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。 研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
| 滴入 KMnO4认溶液的次序(每滴溶液等体积) | KMnO4溶液紫色褪去的时间 |
| 先滴入第 1 滴 | 1min |
| 褪色后再滴入第 2 滴 | 15s |
| 褪色后再滴入第 3 滴 | 3s |
| 褪色后再滴入第 4 滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因________________________________________。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠来标定高锰酸钾济液的浓度。他们准确称取2.680g纯净的草酸钠配成500mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
①高锰酸钾溶液应装在______(填下途中的仪器编号)。

甲 乙 丙 丁
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是______________。
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为________________。
(附原子相对质量K=39Mn=55O=16 Na=23C=12)
 □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
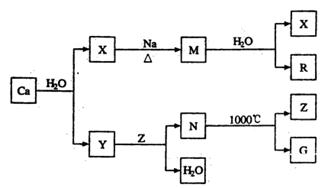
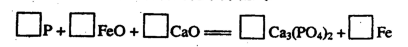
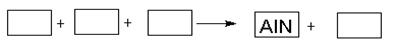
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。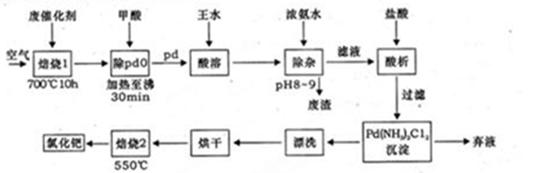

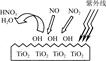
 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。