题目内容
下列反应的离子方程式正确的是( )
| A、NaHCO3溶液与足量Fe2(SO4)3溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ |
| B、足量NaOH溶液与NH4HS溶液反应:OH-+NH4+═NH3?H2O |
| C、向Br2水中加入少量的Na2SO3溶液:Br2+SO32-+H2O═SO42-+2H++2Br- |
| D、在氯化钙溶液中通入少量的二氧化碳:Ca2++CO2+H2O═CaCO3↓+2H+ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.发生相互促进水解反应生成沉淀和气体;
B.漏写HS-与碱的反应;
C.发生氧化还原反应生成硫酸钠和HBr;
D.盐酸酸性大于碳酸,不发生反应.
B.漏写HS-与碱的反应;
C.发生氧化还原反应生成硫酸钠和HBr;
D.盐酸酸性大于碳酸,不发生反应.
解答:
解:A.NaHCO3溶液与足量Fe2(SO4)3溶液反应的离子反应为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,故A正确;
B.足量NaOH溶液与NH4HS溶液反应的离子反应为HS-+2OH-+NH4+═NH3?H2O+S2-+H2O,故B错误;
C.向Br2水中加入少量的Na2SO3溶液的离子反应为Br2+SO32-+H2O═SO42-+2H++2Br-,故C正确;
D.在氯化钙溶液中通入少量的二氧化碳,不发生反应,故D错误;
故选AC.
B.足量NaOH溶液与NH4HS溶液反应的离子反应为HS-+2OH-+NH4+═NH3?H2O+S2-+H2O,故B错误;
C.向Br2水中加入少量的Na2SO3溶液的离子反应为Br2+SO32-+H2O═SO42-+2H++2Br-,故C正确;
D.在氯化钙溶液中通入少量的二氧化碳,不发生反应,故D错误;
故选AC.
点评:本题考查离子反应书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重水解、氧化还原反应及与量有关的离子反应书写的考查,题目难度中等.

练习册系列答案
相关题目
化学与科技、生产、生活密切相关.下列说法不正确的是( )
| A、工业上,用焦炭在高温下还原二氧化硅制得粗硅 |
| B、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 |
| C、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、标准状况下,0.56L丙烷中含有共价键的数目为0.2NA |
| B、常温常压下,6.4g氧气和臭氧中含有的分子总数为0.2NA |
| C、1mol羟基中电子数为10NA |
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染 |
下列实验过程和过程中涉及的离子反应方程式正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- |
| B、Fe(OH)3与氢溴酸溶液混合:Fe(OH)3+3HBr═Fe3++3Br-+3H2O |
| C、用氨水吸收烟道气中的SO2:SO2+2NH3?H2O═2NH4++SO32-+H2O |
| D、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
下列有关化学用语使用正确的是( )
A、羟基乙酸(HOCH2COOH)的缩聚物: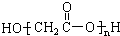 |
B、H2O2的分子结构模型示意图: |
| C、在CS2、PCl5中各原子最外层均能达到8电子的稳定结构 |
| D、淀粉和纤维素的实验式都为 CH2O |
下表是不同温度下水的离子积常数,下列有关叙述正确的是( )
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
| A、若25<t1<t2,则a<1×10-14 |
| B、t2℃时,将一定物质的量浓度的盐酸与氢氧化钠溶液中和后,所得混合溶液pH=7,溶液呈中性 |
| C、25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1 |
| D、t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合,所得混合溶液的pH=2,则V1:V2=11:9(设混合后溶液的体积为原两溶液体积之和) |
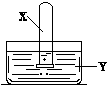 将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是( )
将装满气体X的试管倒置于装有液体Y的水槽中,下列说法合理的是( )