题目内容
17.下列溶液中微粒的关系不正确的是( )| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
分析 A、根据反应H2B(过量)+A-=HB-+HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强;
B、呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,以此计算;
C、依据反应过程和溶液中存在的电荷守恒,溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),c(H+)=c(OH-),据此分析判断;
D、碱的强弱不知,若为强酸、强碱混合,呈中性,若为强酸、弱碱混合,则相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合显碱性.
解答 A、据反应H2B(过量)+A-=B-+HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强,有HB-生成,说明得电子能力A-大于HB-,结合离子能力顺序为A->B2->HB-,故A错误;
B、呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01mol/L,所以用含c的代数式表示CH3COOH的电离常数Ka=$\frac{1{0}^{-7}×0.01}{\frac{c}{2}-0.01}$=$\frac{2×1{0}^{-9}}{c-0.02}$mol•L-1,故B正确;
C、将CO2通入0.1 mol•L-1NaOH溶液中恰好呈中性,溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),c(H+)=c(OH-),则得到c(Na+)=2c(CO32-)+c(HCO3-)=0.1mol/L,故C正确;
D、pH=3硫酸,c(H+)=0.001mol/L,硫酸完全电离,pH=11一元碱BOH,c(OH-)=0.001mol/L,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故D正确;
故选A.
点评 本题主要考查盐类水解、离子浓度大小比较,难度中等,注意熟练利用电荷守恒、物料守恒等解决问题.

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
| A. | 0.1mol苯分子中含有双键数为0.3NA | |
| B. | 1L1mol•L-1碳酸钠溶液中阴离子的数目大于NA | |
| C. | 标准状况下,22.4L乙烷中共含有分子数为NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,转移的电子的数目为0.92NA |
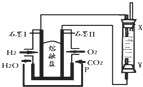 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )
以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | 白色沉淀只能在阳极上产生 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
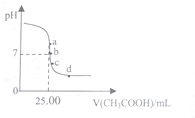 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )| A. | a点:c(CH3COONa)=0.1000 mol•L-1 | B. | b点:c(CH3COONa)=c(CH3COOH) | ||
| C. | c点:c(H+)=c(CH3COO-)+c(CH3COOH) | D. | d点:c(Na+)<c(CH3COO-)+c(CH3COOH) |