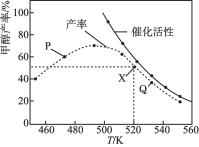
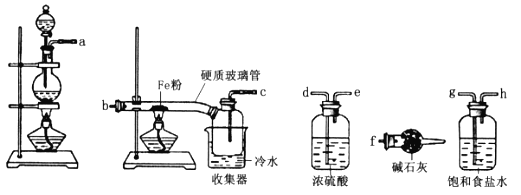
题目内容
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
【答案】C
【解析】
将1.12g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,铁粉的物质的量为![]() ,氯化铁的物质的量为
,氯化铁的物质的量为![]() ;
;
根据反应:![]() ,结合数据判断反应情况,计算生成Fe2+和Fe3+物质的量,若Fe3+过量,加入KSCN溶液会出现红色;
,结合数据判断反应情况,计算生成Fe2+和Fe3+物质的量,若Fe3+过量,加入KSCN溶液会出现红色;
根据反应:![]() ,Fe为还原剂,对应生成的Fe2+为氧化产物;Fe3+为氧化剂,对应生成的Fe2+为还原产物;
,Fe为还原剂,对应生成的Fe2+为氧化产物;Fe3+为氧化剂,对应生成的Fe2+为还原产物;
将1.12g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,铁粉的物质的量为![]() ,氯化铁的物质的量为
,氯化铁的物质的量为![]() ,
,
铁粉与氯化铁的离子反应方程式为:![]() ,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。
,根据反应的物质的量之比等于计量数之比知,0.02mol铁粉完全反应需要0.04mol氯化铁,所以氯化铁剩余0.01mol,生成的Fe2+的物质的量为0.06mol。
A、由于氯化铁剩余了0.01mol,铁完全反应,故A错误;
B、由于氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,故B错误;
C、Fe2+的物质的量为0.06mol,氯化铁的物质的量为0.01mol,所以Fe2+和Fe3+的物质的量之比为6:1,故C正确;
D、还原剂失电子后被氧化的产物为氧化产物,氧化剂得电子后被还原的产物为还原产物,还原剂和氧化剂分别为铁粉、氯化铁,氧化产物与还原产物的物质的量之比是1:2,故D错误;
故答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
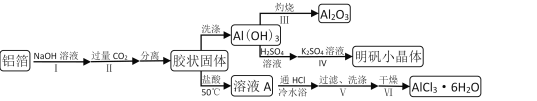
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤II中发生的化学方程式___;步骤Ⅲ发生的化学方程式___。
(2)步骤Ⅲ,下列操作合理的是___。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤Ⅳ的操作是___。
(4)步骤Ⅴ,过滤时,用到的玻璃仪器有___;洗涤时,合适的洗涤剂是___。
(5)步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是___。
(6)由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室需用下列装置制备。
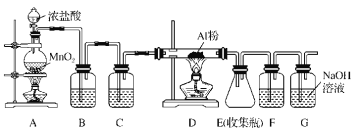
①装置A中发生反应的离子方程式为___。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是___。
③F中试剂的作用是___,用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为___。