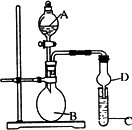
题目内容
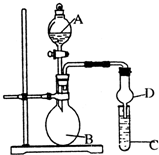 已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:(1)图中D装置在实验中的作用是
(2)验证氢氧化铝能与强酸反应:若B中的试剂为浓盐酸,C中试剂为Na[Al(OH)4]溶液,则A中的试剂为
(3)验证氢氧化铝不能与弱碱反应:若A中的试剂为浓氨水,则B中试剂为
(4)验证氢氧化铝不能与弱酸反应:C中试剂为
分析:(1)球形管有缓冲防止倒吸作用;
(2)实验目的是验证氢氧化铝能与强酸反应,需将B中的试剂浓盐酸中的氯化氢挥发出来,须用浓硫酸,Na[Al(OH)4]溶液与盐酸反应先生成沉淀氢氧化铝,后生成可溶性的氯化铝;
(3)验证氢氧化铝不能与弱碱反应:需将A中浓氨水中的氨气挥发出来,须加碱性的物质,C中试剂为可溶性的铝盐;可溶性的铝盐和氨水反应生成氢氧化铝沉淀;
(4)验证氢氧化铝不能与弱酸反应:B中须制备酸性气体,且该气体溶于水呈弱酸性,C中盛放的试剂为可溶性的偏铝酸盐.
(2)实验目的是验证氢氧化铝能与强酸反应,需将B中的试剂浓盐酸中的氯化氢挥发出来,须用浓硫酸,Na[Al(OH)4]溶液与盐酸反应先生成沉淀氢氧化铝,后生成可溶性的氯化铝;
(3)验证氢氧化铝不能与弱碱反应:需将A中浓氨水中的氨气挥发出来,须加碱性的物质,C中试剂为可溶性的铝盐;可溶性的铝盐和氨水反应生成氢氧化铝沉淀;
(4)验证氢氧化铝不能与弱酸反应:B中须制备酸性气体,且该气体溶于水呈弱酸性,C中盛放的试剂为可溶性的偏铝酸盐.
解答:解:(1)倒置的球形漏斗插入溶液中,气体能被充分吸收,且球形管有缓冲作用防止倒吸,故答案为:防止倒吸;
(2)验证氢氧化铝能与强酸反应,需将B中的试剂浓盐酸中的氯化氢挥发出来,氯化氢是酸性气体,所以需用浓硫酸的吸水性,A为浓硫酸,挥发出来的氯化氢进入C装置,氯化氢极易溶于水,D装置可防止倒吸,
C中Na[Al(OH)4](四羟基合铝酸钠)与盐酸反应先生成沉淀氢氧化铝和氯化钠,最终生成氯化铝、氯化钠与水,所以现象为:先产生白色沉淀,后白色沉淀溶解,
故答案为:浓硫酸;先产生白色沉淀,后白色沉淀溶解;
(3)验证氢氧化铝不能与弱碱反应:需将A中浓氨水中的氨气挥发出来,利用CaO与H2O剧烈反应,NH3?H2O+CaO═NH3↑+Ca(OH)2,生成Ca(OH)2,放出大量热,促进NH3.H2O的分解及NH3的挥发逸出,Ca(OH)2、NaOH等强碱,也促进NH3?H2O的分解及NH3的挥发逸出,所以B中试剂为生石灰(或氢氧化钠固体或碱石灰);氨气是极易溶于水,D装置可防止倒吸,C中盛放能与氨水反应生成氢氧化铝沉淀的铝盐,可选择AlCl3溶液(或硫酸铝溶液);发生的离子反应为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:生石灰(或氢氧化钠固体或碱石灰);AlCl3溶液(或硫酸铝溶液);Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)验证氢氧化铝不能与弱酸反应:B中须制备酸性气体,且该气体溶于水呈弱酸性,可以是二氧化硫气体或二氧化碳气体,所以B中可能发生的化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2SO3+H2SO4=Na2SO4+H2O+SO2↑);C中试剂能与酸性气体反应生成氢氧化铝,所以为Na[Al(OH)4],如与少量二氧化碳反应2NaAl(OH)4+CO2=Na2CO3+2Al(OH)3↓+H2O,
故答案为:Na[Al(OH)4];CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2SO3+H2SO4=Na2SO4+H2O+SO2↑).
(2)验证氢氧化铝能与强酸反应,需将B中的试剂浓盐酸中的氯化氢挥发出来,氯化氢是酸性气体,所以需用浓硫酸的吸水性,A为浓硫酸,挥发出来的氯化氢进入C装置,氯化氢极易溶于水,D装置可防止倒吸,
C中Na[Al(OH)4](四羟基合铝酸钠)与盐酸反应先生成沉淀氢氧化铝和氯化钠,最终生成氯化铝、氯化钠与水,所以现象为:先产生白色沉淀,后白色沉淀溶解,
故答案为:浓硫酸;先产生白色沉淀,后白色沉淀溶解;
(3)验证氢氧化铝不能与弱碱反应:需将A中浓氨水中的氨气挥发出来,利用CaO与H2O剧烈反应,NH3?H2O+CaO═NH3↑+Ca(OH)2,生成Ca(OH)2,放出大量热,促进NH3.H2O的分解及NH3的挥发逸出,Ca(OH)2、NaOH等强碱,也促进NH3?H2O的分解及NH3的挥发逸出,所以B中试剂为生石灰(或氢氧化钠固体或碱石灰);氨气是极易溶于水,D装置可防止倒吸,C中盛放能与氨水反应生成氢氧化铝沉淀的铝盐,可选择AlCl3溶液(或硫酸铝溶液);发生的离子反应为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:生石灰(或氢氧化钠固体或碱石灰);AlCl3溶液(或硫酸铝溶液);Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)验证氢氧化铝不能与弱酸反应:B中须制备酸性气体,且该气体溶于水呈弱酸性,可以是二氧化硫气体或二氧化碳气体,所以B中可能发生的化学反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2SO3+H2SO4=Na2SO4+H2O+SO2↑);C中试剂能与酸性气体反应生成氢氧化铝,所以为Na[Al(OH)4],如与少量二氧化碳反应2NaAl(OH)4+CO2=Na2CO3+2Al(OH)3↓+H2O,
故答案为:Na[Al(OH)4];CaCO3+2HCl=CaCl2+H2O+CO2↑(或Na2SO3+H2SO4=Na2SO4+H2O+SO2↑).
点评:本题主要考查了氢氧化铝的两性,掌握氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应以及偏铝酸盐的性质是解答的关键,题目难度中等.

练习册系列答案
相关题目


 ,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿以下流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)

 +(n-1)H2O
+(n-1)H2O