题目内容
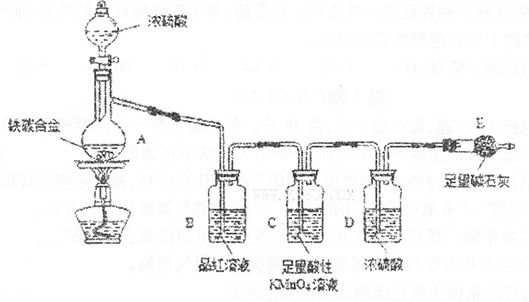
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题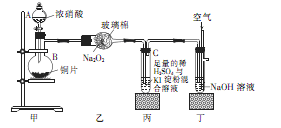
(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol·L—1HCl、1mol·L—1H2SO4、1mol·L—1BaCl2、1mol·L—1Ba(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
(1)分液漏斗(1分);Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(3分)
(2)
(3)I2+SO32-+H2O=2I-+SO42-+2H+(3分)装置编号 实验现象 反应的化学方程式 NO2表现的化学性质 乙 还原性(1分) 丙 溶液变蓝色(1分) NO2+2KI+H2SO4=K2SO4+I2+NO+H2O(3分) 编号 实验操作 预期现象和结论 步骤① 新制饱和溴水(1分) 溴水褪色(1分) 步骤② 另取少量待测液于试管B中,加入过量的2 mol·L-1的盐酸,再滴加适量1 mol·L-1的 BaCl2溶液(1分) 产生白色沉淀,证明含有SO42-(1分) 步骤③ 溶液分层,下层液体呈紫红色(1分)
解析试题分析:(1)根据仪器A的结构特点知,A为分液漏斗;蒸馏烧瓶B中发生的反应为浓硝酸和铜的反应,生成硝酸铜、二氧化氮和水,化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(2)根据装置乙中的反应方程式知,二氧化氮中氮元素的化合价由+4价升高到+5价,被氧化,作还原剂,表现还原性;将二氧化氮通入试管C中,二氧化氮和水反应生成硝酸和一氧化氮,硝酸具有强氧化性将碘离子氧化生成单质碘,碘遇淀粉变蓝色,反应方程式为NO2+2KI+H2SO4=K2SO4+I2+NO+H2O;(3)向试管C滴加足量的Na2SO3溶液,溶液颜色褪去,发生的反应为在水溶液中碘和亚硫酸钠反应生成硫酸钠和氢碘酸,离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+;鉴定SO32—、SO42—和I—,根据题给信息和试剂知,SO32—的检验用饱和溴水,现象为溴水褪色;SO42—检验的操作为取少量待测液于试管B中,加入过量的2 mol·L-1的盐酸,再滴加适量1 mol·L-1的 BaCl2溶液,产生白色沉淀,证明含有SO42-;I—的检验:另取少量待测液于试管C中,滴加饱和氯水和四氯化碳,振荡,溶液分层,下层液体呈紫红色,证明含有碘离子。
考点:考查化学实验基本操作、离子方程式书写和离子检验。

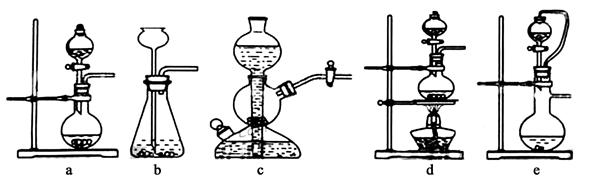
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。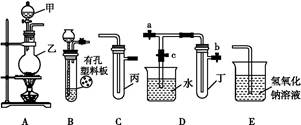
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 。
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
(16分)硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式 ;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是 ;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
| | 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) |
| 猜想② | ,将试纸与标准比色卡对照 [来源:学*科*网Z*X*X*K] | 溶液pH=8 | |
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | | 2S2O32- +2H+══ S↓+SO2↑+H2O | |
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | |
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由: 。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是: 。