题目内容
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C←=O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是___________________________________________________。
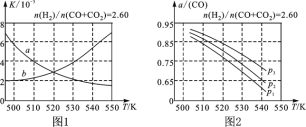
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________________________________。图2中的压强由大到小为__________,其判断理由是___________________________________。
【答案】+41a反应①为放热反应,平衡常数应随温度升高变小减小升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;总结果,随温度升高,使CO的转化率降低p3>p2>p1相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高。
【解析】
(1)根据△H=反应物键能总和-生成物键能总和,即△H1=(1076+2×436-3×413-343-465)kJ·mol-1=-99kJ·mol-1,根据目标反应方程式,③应是②-①,△H3=△H2-△H1=(-58+99)kJ·mol-1=+41kJ·mol-1;
(2)根据图像1,反应①为放热反应,平衡常数应随温度升高变小,曲线a反映化学平衡常数K随温度变化的曲线;
(3)升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;总结果,随温度升高,使CO的转化率降低;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高,推出p3>p2>p1。

【题目】欲测定某NaOH溶液的物质的量浓度,可用0.100 0 mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为________。
(2)滴定至终点的颜色变化为____________。
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为__________。

(4)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1 HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______。(保留四位有效数字)
(5)下列哪些操作会使测定结果偏高________(填字母)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
【题目】下表是元素周期表的一部分,按要求填空![]() 填元素符号或化学式
填元素符号或化学式![]() :
:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
![]() 写出下列元素的元素符号:①______②____________
写出下列元素的元素符号:①______②____________
![]() 在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
![]() 在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______.
在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______.
![]() 在③与④的单质中,化学性质较活泼的是______,判断依据是______;在⑧与的单质中,化学性质较为活泼的是______,判断依据是______.
在③与④的单质中,化学性质较活泼的是______,判断依据是______;在⑧与的单质中,化学性质较为活泼的是______,判断依据是______.

