题目内容
有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3.电池的总反应式为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.该电池放电时,下列说法中正确的是( )
分析:原电池的正极发生得电子的还原反应,该燃料电池燃料为H2,电解质为熔融的K2CO3总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-═H2O+CO2,用总反应减负极得正极反应式:O2+2CO2+4e-═2CO32-,原电池中,阴离子向负极移动,阳离子向正极移动,以形成闭合回路,以此解答该题.
解答:解:A.该燃料电池燃料为H2,电解质为熔融的K2CO3总反应为2H2+O2=2H2O,负极反应为H2+CO32--2e-═H2O+CO2,用总反应减负极得正极反应式:O2+2CO2+4e-═2CO32-,故A错误;
B.原电池中,阴离子向负极移动,阳离子向正极移动,以形成闭合回路,故B正确;
C.外电路中电子由负极流向正极,故C错误;
D.根据总反应式可知,电池中CO32-的物质的量不变,故D错误.
故选B.
B.原电池中,阴离子向负极移动,阳离子向正极移动,以形成闭合回路,故B正确;
C.外电路中电子由负极流向正极,故C错误;
D.根据总反应式可知,电池中CO32-的物质的量不变,故D错误.
故选B.
点评:该题为燃料电池问题,运用原电池的工作原理,写出该电池的正负极反应并判断电子和离子的流向是解题的关键,难度不大.

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
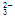 -2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )
-2e-===H2O+CO2。该电池放电时,下列说法中正确的是( )