题目内容
如下所示,A、B、C三个装置中的三个烧杯分别盛有足量的CuCl2溶液.

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是________.
(2)A池中Zn是________极,发生________(填“氧化”或“还原”,下同)反应,电极反应式为________;Cu是________极,发生________反应,电极反应式为________;A中总反应的化学方程式为________.
(3)B池中C是________极,发生________反应,电极反应式为________;Pt是________极,发生________反应,电极反应式为________;B中总反应的化学方程式为________.
(4)C池中Zn是________极,发生________反应,电极反应式为________;Cu是________极,发生________反应,电极反应式为________;反应过程中溶液的浓度________(填“变大”“变小”或“不变”).
解析:
|
答案:(1)A BC (2)负 氧化 Zn-2e- (3)阴 还原 Cu2++2e- (4)阴 还原 Cu2++2e- 解析:判断装置是原电池还是电解池,关键是看它有没有外接直流电源,有则为电解池,无则为原电池.由此可知A为原电池,B和C为电解池.原电池中电极分为正极、负极,相对活泼的金属作负极失去电子发生氧化反应,相对不活泼的金属作正极.所以A中Zn作负极失去电子被氧化,发生反应为Zn-2e- 电解池中规定与直流电源负极相连的电极为阴极,与直流电源正极相连的电极为阳极.在外电场的作用下,溶液中的H+和Cu2+均移向阴极,但因盐溶液中阳离子得电子能力Cu2+>H+,因而发生还原反应Cu2++2e- 装置C中阳极为活性电极,当阳极不是惰性电极时,电极本身会被强迫失电子而发生氧化反应Cu-2e- |

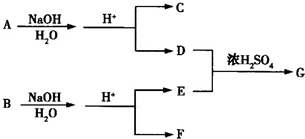
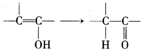
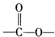 基团.
基团.
 B.
B. C.
C. D.
D. E.
E.
 B.
B. C.
C. D.
D. E.
E. B.
B. C.
C. D.
D. E.
E.