题目内容
已知①25℃时,难溶电解质的溶度积常数:Ksp(CaC2O4)=2×10-9,②25℃时,100 mL 0.4 mol·L-1 H2C2O4水溶液中,用KOH固体来调节溶液pH(忽略体积变化),得到H2C2O4、HC2O4-、C2O42-三种微粒含量与溶液pH的变化关系如图所示。
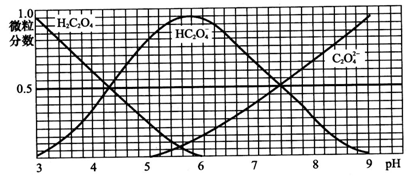
请回答下列问题:
(1) pH=5.2时,H2C2O4、HC2O4-、C2O42-浓度从大到小依次是__________。
(2)向水中加入KHC2O4固体会使水的电离平衡向_______ 移动,解释其原因是__________。
(3)将500 mL0.2mol·L-1 H2C2O4与500 mL0.2mol·L-1 K2C2O4混合,关于所得溶液的下列关系式中错误的是 ( )
A.c(K+)>c(H+)>c(C2O42-)>c(H2C2O4)
B.c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)
C.c(K+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4)
D. c(C2O42-)>c(H2C2O4)>c(HC2O4-)
(4) 25℃时向1L1×10-4 moI/L H2C2O4溶液中加入1× 10-4 mol CaCl2固体,调节溶液pH=9,请通过计算判断是否产生白色沉淀?_________(填“是”“否”或“无法确定”)。
(5)为了测定血液中的钙离子含量,通常向样品中加入K2C2O4使之转化为CaC2O4沉淀,再向过滤出的沉淀中加入 过量的硫酸将沉淀转化为H2C2O4,最后用高锰酸钾溶液滴定。请写出滴定时发生反应的离子方程式:_____________。
(1) pH=5.2时,H2C2O4、HC2O4-、C2O42-浓度从大到小依次是__________。
(2)向水中加入KHC2O4固体会使水的电离平衡向_______ 移动,解释其原因是__________。
(3)将500 mL0.2mol·L-1 H2C2O4与500 mL0.2mol·L-1 K2C2O4混合,关于所得溶液的下列关系式中错误的是 ( )
A.c(K+)>c(H+)>c(C2O42-)>c(H2C2O4)
B.c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)
C.c(K+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4)
D. c(C2O42-)>c(H2C2O4)>c(HC2O4-)
(4) 25℃时向1L1×10-4 moI/L H2C2O4溶液中加入1× 10-4 mol CaCl2固体,调节溶液pH=9,请通过计算判断是否产生白色沉淀?_________(填“是”“否”或“无法确定”)。
(5)为了测定血液中的钙离子含量,通常向样品中加入K2C2O4使之转化为CaC2O4沉淀,再向过滤出的沉淀中加入 过量的硫酸将沉淀转化为H2C2O4,最后用高锰酸钾溶液滴定。请写出滴定时发生反应的离子方程式:_____________。
(1)c(HC2O4-)>c(H2C2O4)>c(C2O42-)
(2)左;因为KHC2O4以电离为主,电离的H+抑制了水的电离
(3)CD
(4)是
(5)2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O
(2)左;因为KHC2O4以电离为主,电离的H+抑制了水的电离
(3)CD
(4)是
(5)2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).