题目内容
如图所示,将Zn棒和Cu棒插入1L 2mol?L-1稀H2SO4中下列说法正确的是( )
A.若电键K与N连接,由于发生原电池反应,Zn棒被保护不会腐蚀
B.若电键K与N连接,Zn棒上发生的反应是2H+-2e-=H2↑
C.若电键K与M连接,将稀H2SO4换成CuSO4溶液,可实现Zn棒上镀铜
D.若电键K与M连接,Cu棒上发生还原反应
【答案】分析:根据示意图可知开关K连接M为电解池,K连接N为原电池,根据电解池和原电池的工作原理,写出电极反应,进行判断;
解答:解:A、若电键K与N连接,由于发生原电池反应,锌做负极失去电子发生氧化反应 被腐蚀,故A错误;
B、若电键K与N连接,Zn棒上发生的反应是Zn-2e-=Zn2+,故B错误;
C、若电键K与M连接,是电解池,将稀H2SO4换成CuSO4溶液,阳极是锌发生电极反应Zn-2e-=Zn2+,阴极是铜发生电极反应Cu2++2e-=Cu,所以不能实现Zn棒上镀铜,故C错误;
D、若电键K与M连接阳极是锌,阴极是铜,铜棒上发生还原反应,故D正确;
故选D.
点评:本题考查了原电池、电解池的工作原理,明确K的连接装置为原电池还是电解池时解答本题的关键.
解答:解:A、若电键K与N连接,由于发生原电池反应,锌做负极失去电子发生氧化反应 被腐蚀,故A错误;
B、若电键K与N连接,Zn棒上发生的反应是Zn-2e-=Zn2+,故B错误;
C、若电键K与M连接,是电解池,将稀H2SO4换成CuSO4溶液,阳极是锌发生电极反应Zn-2e-=Zn2+,阴极是铜发生电极反应Cu2++2e-=Cu,所以不能实现Zn棒上镀铜,故C错误;
D、若电键K与M连接阳极是锌,阴极是铜,铜棒上发生还原反应,故D正确;
故选D.
点评:本题考查了原电池、电解池的工作原理,明确K的连接装置为原电池还是电解池时解答本题的关键.

练习册系列答案
相关题目
 (2011?宝鸡三模)如图所示,将Zn棒和Cu棒插入1L 2mol?L-1稀H2SO4中下列说法正确的是( )
(2011?宝鸡三模)如图所示,将Zn棒和Cu棒插入1L 2mol?L-1稀H2SO4中下列说法正确的是( )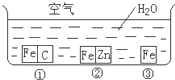 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: