题目内容
(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈 性,溶液中c(NH4+)与c(Cl-)的大小关系是c(NH4+) c(Cl-);(填“中”“酸”“碱”;“>”“<”“=”)
(2)将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈 性,溶液中c(NH4+)与c(Cl-)的大小关系是c(NH4+) c(Cl-).(填“中”“酸”“碱”;“>”“<”“=”)
(2)将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)室温下,等物质的量浓度、等体积的盐酸和氨水混合,n(HCl)=n(NH3),恰好完全反应生成NH4Cl,为强酸弱碱盐,溶液显酸性,再结合电荷守恒解答;
(2)根据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性,再结合电荷守恒解答.
(2)根据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性,再结合电荷守恒解答.
解答:
解:(1)室温下,等物质的量浓度、等体积的盐酸和氨水混合,n(HCl)=n(NH3),恰好完全反应生成NH4Cl,为强酸弱碱盐,溶液中铵根离子水解,溶液呈酸性,即c(H+)>c(OH-),溶液中存在电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),
故答案为:酸;<;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,即c(H+)<c(OH-),溶液中存在电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)<c(NH4+),
故答案为:碱;>.
故答案为:酸;<;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,即c(H+)<c(OH-),溶液中存在电荷守恒,c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)<c(NH4+),
故答案为:碱;>.
点评:本题考查了酸碱过量判断、盐类水解等知识,明确溶液中的溶质及其性质是解本题关键,再结合电荷守恒分析解答,题目难度中等.注意这两种类型题目的条件类比.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生.反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色.试管底部出现灰绿色悬浮物.收集少量黑色粉末与稀硫酸作用有气泡产生.则下列反应没有发生的是( )
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
下列关于溶液的说法正确的是( )
| A、1L 0.2mol/L CaCl2溶液中,Cl-数目约为0.2×6.02×1023个 |
| B、50mL 1mol/L AlCl3溶液与100mL 3mol/L KClO3溶液中的Cl-物质的量浓度相等 |
| C、0.5L 1mol/L MgCl2溶液与0.2L 1mol/L KCl溶液中的Cl-的数目之比为5:2 |
| D、在100mL Na2SO4和KNO3的混合溶液中,Na+的物质的量浓度与SO42-的物质的量浓度之比为2:1 |
下列离子方程式正确的是( )
| A、碳酸钡与盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑ |
| B、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
| C、氯气通入蒸馏水中:Cl2+H2O=Cl-+ClO-+2H+ |
| D、CO2通入过量的澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
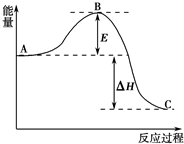 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.