题目内容
下列叙述不正确的是( )
分析:A.混合溶液中c(OH-)=
=0.01mol/L,再根据水的离子积常数计算c(H+),从而确定混合溶液的pH;
B.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒、物料守恒判断;
C.醋酸是弱电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积的两种溶液中和氢氧化钠溶液,需要氢氧化钠的物质的量与酸的物质的量成正比;
D.根据各种物质与氯化铁混合产生的现象是否相同判断,如果产生的现象不同就能一次鉴别.
| 0.02mol/L×0.01L×(2-1) |
| 0.02L |
B.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒、物料守恒判断;
C.醋酸是弱电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积的两种溶液中和氢氧化钠溶液,需要氢氧化钠的物质的量与酸的物质的量成正比;
D.根据各种物质与氯化铁混合产生的现象是否相同判断,如果产生的现象不同就能一次鉴别.
解答:解:A.混合溶液中c(OH-)=
=0.01mol/L,则c(H+)=
mol/L=10-12mol/L,所以其pH=12,故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(HCOO-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(HCOOH)+c(HCOO-),所以得c(OH-)=c(HCOOH)+c(H+),故B正确;
C.醋酸是弱电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积的两种溶液中和氢氧化钠溶液,需要氢氧化钠的物质的量与酸的物质的量成正比,pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以中和氢氧化钠,醋酸需要的氢氧化钠多,故C错误;
D.根据各种物质与氯化铁混合产生的现象是否相同判断,如果产生的现象不同就能一次鉴别,苯酚和氯化铁溶液混合显紫色,淀粉碘化钾溶液与氯化铁溶液变蓝色,乙酸和氯化铁溶液混合为黄色,氢氧化钾溶液和氯化铁溶液混合产生红褐色沉淀,所以反应现象不同,则可以一次就能鉴别,故D正确;
故选C.
| 0.02mol/L×0.01L×(2-1) |
| 0.02L |
| 10-14 |
| 10-2 |
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(HCOO-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(HCOOH)+c(HCOO-),所以得c(OH-)=c(HCOOH)+c(H+),故B正确;
C.醋酸是弱电解质,氯化氢是强电解质,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,等体积的两种溶液中和氢氧化钠溶液,需要氢氧化钠的物质的量与酸的物质的量成正比,pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,所以中和氢氧化钠,醋酸需要的氢氧化钠多,故C错误;
D.根据各种物质与氯化铁混合产生的现象是否相同判断,如果产生的现象不同就能一次鉴别,苯酚和氯化铁溶液混合显紫色,淀粉碘化钾溶液与氯化铁溶液变蓝色,乙酸和氯化铁溶液混合为黄色,氢氧化钾溶液和氯化铁溶液混合产生红褐色沉淀,所以反应现象不同,则可以一次就能鉴别,故D正确;
故选C.
点评:本题涉及盐类水解、酸碱混合溶液定性判断、物质的鉴别等知识点,根据盐类水解特点、弱电解质电离特点、物质之间反应颜色变化来分析解答即可,注意氯化铁和碘化钾发生氧化还原反应生成碘单质,为易错点.

练习册系列答案
相关题目
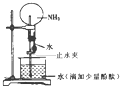 如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )
如图是实验室进行氨溶于水的“喷泉实验”的装置,下列叙述不正确的是( )| A、该实验说明氨气是一种极易溶于水的气体 | B、进入烧瓶中的液体颜色由无色变为红色,说明氨水有碱性 | C、氨水很稳定,将烧瓶中的红色溶液加热,颜色不会发生变化 | D、形成“喷泉”的主要原因是氨气溶于水后,烧瓶内的气压小于大气压 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都能燃烧,生成二氧化碳和水 | B、都容易发生加成反应 | C、乙烯易发生加成反应,苯只能在特殊条件下才发生加成反应 | D、乙烯易被酸性高锰酸钾溶液氧化,苯不能被酸性高锰酸钾溶液氧化 |