题目内容
7.在 2L密闭容器中发生反应N2+3H2?2NH3,经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
分析 同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(NH3)=$\frac{2}{3}$v(H2)=$\frac{2}{3}$×0.6mol/(L•s)=0.4mol/(L.s),反应速率=$\frac{\frac{△n}{V}}{△t}$,据此计算反应时间.
解答 解:同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(NH3)=$\frac{2}{3}$v(H2)=$\frac{2}{3}$×0.6mol/(L•s)=0.4mol/(L.s),反应速率=$\frac{\frac{△n}{V}}{△t}$,所以反应时间=$\frac{\frac{△n}{V}}{v}$=$\frac{\frac{2.4mol}{2L}}{0.4mol/(L.s)}$=3s,故选C.
点评 本题考查反应速率有关计算,明确反应速率与计量数关系是解本题关键,熟悉反应速率基本公式,题目难度不大.

练习册系列答案
相关题目
2.下列共价化合物中所有原子都满足最外层8电子结构的是( )
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质氧化性:X>Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
19.当前在人类已知的化合物中,品种最多的是( )
| A. | ⅤA 族元素的化合物 | B. | ⅢB族元素的化合物 | ||
| C. | 过渡元素的化合物 | D. | ⅣA 族元素的化合物 |
16.在下列有关晶体的叙述中错误的是( )
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
17.对于NaHCO3与Na2CO3的性质,下列叙述错误的是( )
| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
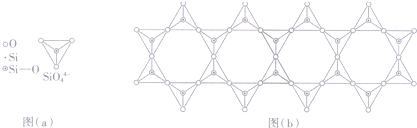
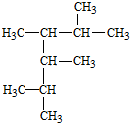 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷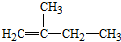 2-甲基-1-丁烯
2-甲基-1-丁烯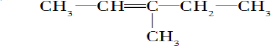 .
. .
.