题目内容
下列图象对应不正确的是( )
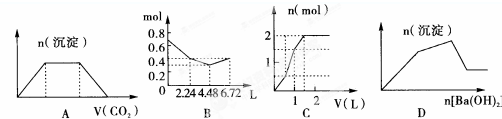

| A、将足量CO2通入含KOH和Ca(OH)2的混合液中,生成沉淀的物质的量(n)与通入CO2体积(y)的关系图A |
| B、往含0.2 molNaOH和0.1 mol Ca(OH)2的溶液中持续稳定地通人CO2气体,当气体为6.72 L(标态)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系图B |
| C、向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,产生沉淀的物质的量(n)与加入B(OH)2溶液积(V)间的关系图C |
| D、KAl(SO4)2液中逐滴加入Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图D |
考点:离子方程式的有关计算
专题:
分析:A、CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应,最后是碳酸钡和水以及二氧化碳的反应;
B、n(CO2)=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓;
C、根据向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,显示钡离子和硫酸根离子之间反应生成沉淀、氢离子和氢氧根离子生成水的反应,待氢离子反应完毕后,氢氧和镁离子反应生成沉淀;
D、向KAl(SO4)2溶液中滴加Ba(OH)2溶液,先反应生成硫酸钡和氢氧化铝,氢氧化钡过量时,氢氧化铝溶解,但硫酸钡不溶.
B、n(CO2)=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓;
C、根据向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,显示钡离子和硫酸根离子之间反应生成沉淀、氢离子和氢氧根离子生成水的反应,待氢离子反应完毕后,氢氧和镁离子反应生成沉淀;
D、向KAl(SO4)2溶液中滴加Ba(OH)2溶液,先反应生成硫酸钡和氢氧化铝,氢氧化钡过量时,氢氧化铝溶解,但硫酸钡不溶.
解答:
解:由图可知,开始阶段发生CO2与Ca(OH)2的反应,Ca2++CO2+2OH-═CaCO3↓+H2O,然后是不生成沉淀,沉淀也不溶解,发生CO2与KOH溶液的反应,CO2+2OH-═CO32-+H2O,最后是BaCO3+CO2+H2O═Ba2++2HCO3-,故A正确;
B、解:n(CO2)=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ca2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:2x+y=0.4,x+y=0.3,解得x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,
②Ca2++CO32-=CaCO3↓,离子浓度迅速减小,
③OH-+CO2=HCO3-,
所以图象符合,故B正确;
C、向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,显示钡离子和硫酸根离子之间反应生成沉淀、氢离子和氢氧根离子生成水的反应,待氢离子反应完毕后,氢氧和镁离子反应生成沉淀,根据反应的离子方程式,当加入氢氧化钡1.5mol时,得到硫酸钡1.5mol,氢氧化镁0.5mol,沉淀量达到了最大是2mol,故C正确;
D、向KAl(SO4)2溶液中滴加Ba(OH)2溶液,先反应生成硫酸钡和氢氧化铝,氢氧化钡过量时,氢氧化铝溶解,但硫酸钡不溶,发生的离子反应为3SO42-+3Ba2++2Al3++6OH-=2Al(OH)3↓+3BaSO4↓、SO42-+Ba2++Al(OH)3+OH-=AlO2-+2H2O+BaSO4↓,开始生成沉淀的阶段不会出现转折,故D错误;
故选D.
B、解:n(CO2)=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ca2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:2x+y=0.4,x+y=0.3,解得x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,
②Ca2++CO32-=CaCO3↓,离子浓度迅速减小,
③OH-+CO2=HCO3-,
所以图象符合,故B正确;
C、向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol?L-1Ba(OH)2溶液,显示钡离子和硫酸根离子之间反应生成沉淀、氢离子和氢氧根离子生成水的反应,待氢离子反应完毕后,氢氧和镁离子反应生成沉淀,根据反应的离子方程式,当加入氢氧化钡1.5mol时,得到硫酸钡1.5mol,氢氧化镁0.5mol,沉淀量达到了最大是2mol,故C正确;
D、向KAl(SO4)2溶液中滴加Ba(OH)2溶液,先反应生成硫酸钡和氢氧化铝,氢氧化钡过量时,氢氧化铝溶解,但硫酸钡不溶,发生的离子反应为3SO42-+3Ba2++2Al3++6OH-=2Al(OH)3↓+3BaSO4↓、SO42-+Ba2++Al(OH)3+OH-=AlO2-+2H2O+BaSO4↓,开始生成沉淀的阶段不会出现转折,故D错误;
故选D.
点评:本题考查较为综合,试题结合图象识别,增加了试题的难度,该题综合性强,贴近高考,试题注重基础,侧重对学生能力的培养和解题方法的训练与指导,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、在固定容积的密闭容器中发生反应:A(s)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | ||
| B、对于反应C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平稳常数增大,则反应速率也一定增大 | ||
C、向01mol?L-1的NH3?H2O中加入氯化铵固体,则溶液中
| ||
D、常温下向Mg(OH)2悬浊液中加入MgCl2溶液,溶液中
|
某课外小组同学通过实验发现钾和钠的化学性质相似.下列解释最合理的是( )
| A、都属于金属元素 |
| B、原子半径相差不大 |
| C、元素的最高正化合价相同 |
| D、原子的最外层电子数相同 |
当航天飞机返回地球进入大气层时,由于空气的剧烈摩擦,航天飞机尖端的温度超过1000℃.为防止高温将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层.制作保护层的材料可能为( )
| A、合成塑料 | B、新型陶瓷 |
| C、镁铝合金 | D、不锈钢 |
下列不属于金属的通性的是( )
| A、导电导热性 | B、延展性 |
| C、有光泽 | D、熔点很高 |
将15.6gNa2O2和5.4gAl时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准况下的HCl气体6.72L,若反应过程中溶液的体积保持不变( )
| A、最终得到7.8g的沉淀 |
| B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C、反应过程中得到6.72L的气体(标准状况下) |
| D、最终得到的溶液中c(NaCl)=2mol/L |
下列有关物理量相应的单位表达中,错误的是( )
| A、摩尔质量g/mol |
| B、气体摩尔体积mol/L |
| C、溶解度g |
| D、密度g/cm3 |
下列物质的分类合理的是( )
| A、碱性氧化物:Na2O、CaO、MgO、CO2 |
| B、碱:纯碱、烧碱、熟石灰、苛性钠 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、氧化物:CO2、NO、SO2、H2O |