题目内容
已知Fe2+和Cl2在溶液中因发生氧化还原反应而不能大量共存。现将过量的Cl2通入FeBr2溶液中,下列离子方程式正确的是( )A.Cl2+2Br-====Br2+2Cl-
B.Fe2++2Br-+Cl2====Fe3++Br2+2Cl-
C.2Fe2++2Br-+2Cl2====2Fe3++4Cl-+Br2
D.2Fe2++4Br-+3Cl2====2Fe3++6Cl-+2Br2
解析:由于通入足量的Cl2,不仅将Fe2+氧化成Fe3+,而且把Br-氧化成Br2。如果Cl2少量,应先氧化Fe2+,因为Fe2+的还原性大于Br-的还原性。
答案:D

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下表是实验室制备气体的有关内容:
(1)上述气体中,从制备过程看,必须选择合适的氧化剂才能实现的是 (填气体的化学式);从反应原理看,明显不同于其它两种气体的是 (填气体的化学式);从收集方法来看,只能用一种方法收集的是 (填气体的化学式).
(2)根据表中所列实验原理,从图甲装置中选择合适的气体发生装置,将其选项填入表中相应编号的空格中.
(3)若用上述制备NH3的装置制备O2,则选择的试剂为 (填化学式);若用上述制备O2的装置制备
NH3,则选择的试剂的名称为 .
(4)若用排空气法收集Cl2,请画出气体收集装置图.
(5)有图乙所示无机物的转化关系,已知B和Y是上述三种气体中的两种.
a.当w为MnO2时,反应①不加热就能反应,反应④加热才能顺利进行,写出反应①的化学方程式.
b.当w为KMnO2时,反应①加热才能进行,反应④不加热就能进行,写出反应④的离子方程式. .
(6)已知Fe2++Br2=2Fe3++2Br-,现向100mL的FeBr2溶液中通入标准状况下Cl23.36L,充分反应后,测得溶液中Cl-与Br-的物质的量浓度相等(设通入Cl2前后溶液体积不变),则原FeBr2溶液中溶质的物质的量浓度为 .
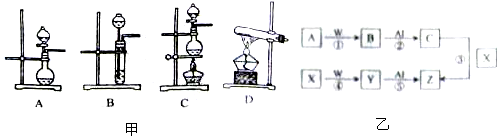
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
(2)根据表中所列实验原理,从图甲装置中选择合适的气体发生装置,将其选项填入表中相应编号的空格中.
(3)若用上述制备NH3的装置制备O2,则选择的试剂为
NH3,则选择的试剂的名称为
(4)若用排空气法收集Cl2,请画出气体收集装置图.
(5)有图乙所示无机物的转化关系,已知B和Y是上述三种气体中的两种.
a.当w为MnO2时,反应①不加热就能反应,反应④加热才能顺利进行,写出反应①的化学方程式.
b.当w为KMnO2时,反应①加热才能进行,反应④不加热就能进行,写出反应④的离子方程式.
(6)已知Fe2++Br2=2Fe3++2Br-,现向100mL的FeBr2溶液中通入标准状况下Cl23.36L,充分反应后,测得溶液中Cl-与Br-的物质的量浓度相等(设通入Cl2前后溶液体积不变),则原FeBr2溶液中溶质的物质的量浓度为

(6分) 氢氧化铜悬浊液中存在如下平衡:
Cu(OH)2 (s)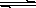 Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
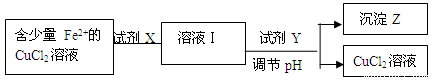
已知Fe2+ 、Cu2+ 、Fe3+ 三种离子开始沉淀和完全沉淀时溶液pH值如下:
|
金属 离子 |
pH |
|
|
开始沉淀 |
完全沉淀 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Cu2+ |
4.4 |
6.4 |
|
Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是
A.CuCO3 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0