题目内容
下表是元素周期表的一部分,表中所列的字母分别代表一种元素.
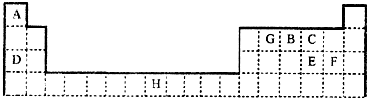
请回答下列问题:
(1)元素H位于元素周期表的 区,其原子结构示意图为 .
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种.
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是 (用离子方程式表示).在工业上用惰性电极电解DF的饱和溶液时,阴极的电极反应式为 .
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为 (用对应的元素符号表示).
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为 .

请回答下列问题:
(1)元素H位于元素周期表的
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为
分析:由元素在周期表中的位置可知,A为H、G为C、B为N、C为O、D为Na、E为S、F为Cl、H为Fe,
(1)H为Fe,处于d区,原子核外电子数为26,根据核外电子排布规律书写;
(2)表中各元素中基态原子中未成对电子数与其所在周期数相同的元素有H、C、O;
(3)化合物Na2S为强碱弱酸盐,其水溶液中S2-离子水解而使溶液呈碱性;工业上用惰性电极电解NaCl的饱和溶液,阴极发生还原反应,水在阴极放电生成氢气与OH-;
(4)NOCl分子的所有原子都达到8电子结构,N原子成3个共价键、O原子成2个共价键、Cl原子成1个共价键,故应是O原子与N之间成2对共用电子对,N原子与Cl之间成1对共用电子对;
(5)Fe(CO)5,熔沸点低,易溶于非极性溶剂,应属于分子晶体.
(1)H为Fe,处于d区,原子核外电子数为26,根据核外电子排布规律书写;
(2)表中各元素中基态原子中未成对电子数与其所在周期数相同的元素有H、C、O;
(3)化合物Na2S为强碱弱酸盐,其水溶液中S2-离子水解而使溶液呈碱性;工业上用惰性电极电解NaCl的饱和溶液,阴极发生还原反应,水在阴极放电生成氢气与OH-;
(4)NOCl分子的所有原子都达到8电子结构,N原子成3个共价键、O原子成2个共价键、Cl原子成1个共价键,故应是O原子与N之间成2对共用电子对,N原子与Cl之间成1对共用电子对;
(5)Fe(CO)5,熔沸点低,易溶于非极性溶剂,应属于分子晶体.
解答:解:由元素在周期表中的位置可知,A为H、G为C、B为N、C为O、D为Na、E为S、F为Cl、H为Fe,
(1)H为Fe,处于d区,原子核外电子数为26,故其原子结构示意图为: ,
,
故答案为:d; ;
;
(2)表中各元素中基态原子中未成对电子数与其所在周期数相同的元素有H、C、O,工业3种,
故答案为:3;
(3)化合物Na2S为强碱弱酸盐,其水溶液中S2-离子水解S2-+H2O?H-+OH-,破坏水的电离平衡,溶液呈碱性;工业上用惰性电极电解NaCl的饱和溶液,阴极发生还原反应,水在阴极放电生成氢气与OH-,阴极电极反应式为:2H2O+4e-=H2↑+OH-,
故答案为:S2-+H2O?H-+OH-;2H2O+4e-=H2↑+OH-;
(4)NOCl分子的所有原子都达到8电子结构,N原子成3个共价键、O原子成2个共价键、Cl原子成1个共价键,故应是O原子与N之间成2对共用电子对,N原子与Cl之间成1对共用电子对,则NOCl的电子式为: ,
,
故答案为: ;
;
(5)Fe(CO)5,常温下为液态,熔沸点低,易溶于非极性溶剂,应属于分子晶体,
故答案为:分子晶体.
(1)H为Fe,处于d区,原子核外电子数为26,故其原子结构示意图为:
 ,
,故答案为:d;
 ;
;(2)表中各元素中基态原子中未成对电子数与其所在周期数相同的元素有H、C、O,工业3种,
故答案为:3;
(3)化合物Na2S为强碱弱酸盐,其水溶液中S2-离子水解S2-+H2O?H-+OH-,破坏水的电离平衡,溶液呈碱性;工业上用惰性电极电解NaCl的饱和溶液,阴极发生还原反应,水在阴极放电生成氢气与OH-,阴极电极反应式为:2H2O+4e-=H2↑+OH-,
故答案为:S2-+H2O?H-+OH-;2H2O+4e-=H2↑+OH-;
(4)NOCl分子的所有原子都达到8电子结构,N原子成3个共价键、O原子成2个共价键、Cl原子成1个共价键,故应是O原子与N之间成2对共用电子对,N原子与Cl之间成1对共用电子对,则NOCl的电子式为:
 ,
,故答案为:
 ;
;(5)Fe(CO)5,常温下为液态,熔沸点低,易溶于非极性溶剂,应属于分子晶体,
故答案为:分子晶体.
点评:本题考查位置结构性质关系,涉及核外电子排布、盐类水解、电解、电子式、晶体类型与性质等,熟练掌握元素周期表结构,(3)中注意掌握离子放电顺序书写电极反应式,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是