题目内容
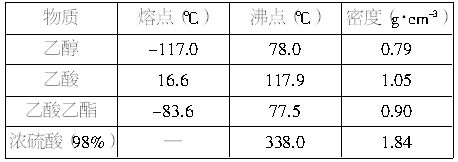
| |||||||||||||||||||||||||||
答案:
解析:
解析:
(1) |
⑤②④③① |
(2) |
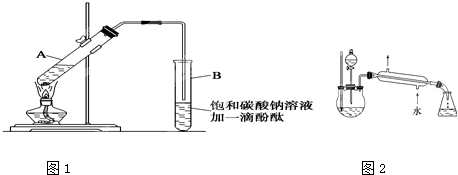
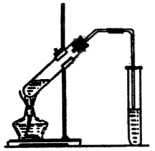
在30 mL的大试管中先加入3 mL乙醇,然后边振荡边慢慢加入2 mL冰醋酸和2 mL浓硫酸 |
(3) |
CH3CH2COOH+C2H5OH |
(4) |
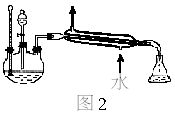
防止倒吸,防止反应物乙酸和乙醇大量挥发出去 |
(5) |
振荡时产生大量气泡,挥发出去的乙酸和碳酸钠反应产生大量的CO2气体,乙酸的酸性比碳酸强;乙酸乙酯层在上层,说明乙酸乙酯在饱和碳酸钠溶液里溶解度很小且密度较小 |
(6) |
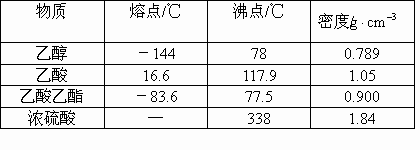
乙醇,因其沸点(78℃)较乙酸的沸点(117.9℃)低,易挥发 |

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目

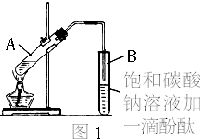 中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。