题目内容
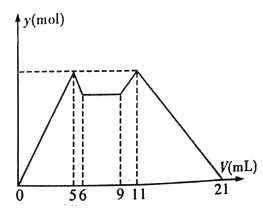
【题目】某离子反应涉及到H2O、ClO﹣、NH4+、OH﹣、N2、Cl﹣等微粒,其中N2、ClO﹣的物质的量随时间变化的曲线如图所示,下列说法正确的是( ) 
A.该反应中Cl﹣为氧化产物
B.消耗1 mol还原剂,转移6 mol电子
C.反应后溶液的酸性减弱
D.NH4+被ClO﹣氧化成N2
【答案】D
【解析】解:反应的方程式应为3ClO﹣+2NH4++2OH﹣=N2↑+5H2O+3Cl﹣,
A.由方程式可知,N元素的化合价升高,则N2为氧化产物,故A错误;
B.N元素化合价由﹣3价升高到0价,则消耗1mol还原剂,转移3mol电子,故B错误;
C.反应在碱性条件下发生,反应消耗OH﹣,反应后溶液的碱性减弱,故C错误;
D.由方程式可知,NH4+被ClO﹣氧化成N2,故D正确.
故选D.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测.某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+ , 其次是Fe3+ , Fe2+ , Al3+ , Ca2+ , Mg2+) 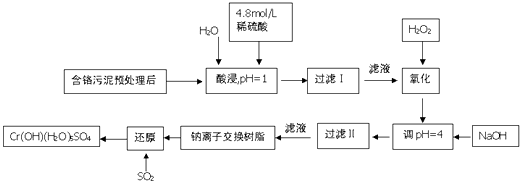
常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | ﹣ |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是(至少一条)
(2)调pH=4.0是为了除去(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(3)钠离子交换树脂的原理为Mn++n NaR→MRn+nNa+ , 被交换的杂质离子是(填Fe3+ , Al3+ , Ca2+ , Mg2+)
(4)试配平下列氧化还原反应方程式:Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4 .