题目内容
11.下列说法中错误的是( )| A. | 苯丙醇胺的结构简式为: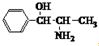 ,其分子中有2个手性碳原子 ,其分子中有2个手性碳原子 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 完全由非金属元素形成的化合物中也可能含有离子键 | |
| D. | CO2、SiO2都是分子晶体 |
分析 A.手性碳原子是碳原子上连接4个不同的原子或原子团;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键;
C.铵盐是由非金属元素构成的离子化合物;
D.二氧化硅属于原子晶体.
解答 解:A.手性碳原子是碳原子上连接4个不同的原子或原子团,苯丙醇胺的结构简式为: ,分子中与苯环相连的C原子以及与该原子相连的C原子为手性碳原子,所以该分子有2个手性碳原子,故A正确;
,分子中与苯环相连的C原子以及与该原子相连的C原子为手性碳原子,所以该分子有2个手性碳原子,故A正确;
B.NH4+中氮原子提供孤电子对,氢原子提供空轨道,从而形成配位键,[Cu(NH3)4]2+中铜原子提供空轨道,氮原子提供孤电子对,所以形成配位键,故B正确;
C.铵盐是由非金属元素构成的离子化合物,铵盐中含有离子键,所以完全由非金属元素形成的化合物中也可能含有离子键,故C正确;
D.CO2属于分子晶体,SiO2中不存在分子,属于原子晶体,故D错误;
故选D.
点评 本题考查了物质结构和性质,题目难度不大,明确手性原子特点、晶体类型的判断方法、配位键的判断即可解答,难点是手性碳原子和配位键的判断.

练习册系列答案
相关题目
19.已知可逆反应:N2(g)+3H2(g)?2NH3(g),下列关于此反应的说法中错误的是( )
| A. | 增大N2的浓度可使该反应的反应速率加快 | |
| B. | 升高温度,该反应的反应速率加快 | |
| C. | 将1 mol N2和3 mol H2混合进行反应,反应完成时得到2 mol NH3 | |
| D. | 单位时间内生成1 mol N2,同时消耗3 mol H2,说明该反应达到平衡状态 |
6.硝酸工业尾气中含有NO和NO2的混合物,可用纯碱溶液吸收,有关的化学反应为:
NO+NO2+Na2CO3=2NaNO2+CO2 ①
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
现用足量的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g.则吸收液中和NaNO2和NaNO3物质的量之比为( )
NO+NO2+Na2CO3=2NaNO2+CO2 ①
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
现用足量的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g.则吸收液中和NaNO2和NaNO3物质的量之比为( )
| A. | 5:3 | B. | 3:1 | C. | 1:1 | D. | 2:3 |
16.下列第三周期的元素中,原子半径最小的是( )
| A. | S | B. | F | C. | Na | D. | O |
20.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 医学上,血液透析是利用了胶体的渗析原理 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 |