题目内容
4.有机物的混合物,只要质量一定,无论他们按什么比例混合,完全燃烧,产生的水的质量一定的是( )| A. | 甲苯和丙三醇 | B. | 乙醇和丙烯 | C. | 甲烷和乙烯 | D. | 苯和丁炔 |
分析 有机物的总质量一定,完全燃烧,产生的水的质量一定,由H原子守恒可知,有机物中H元素的质量分数相同,以此来解答.
解答 解:题目要求只需两物质的氢的质量百分数H%相同即可,
A.甲苯(C7H8)和丙三醇(C3H8O3)中H%均为$\frac{8}{92}$,符合题意,故A选;
B.乙醇(C2H6O)和丙烯(C3H6)中H元素的质量分数不同,故B不选;
C.甲烷(CH4)和乙烯(C2H4)中H元素的质量分数不同,故C不选;
D.苯(C6H6)和丁炔(C4H6)中H元素的质量分数不同,故D不选;
故选A.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握H原子守恒及H元素的质量分数相同为解答的关键,侧重分析与计算能力的考查,注意有机物的分子式,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
14.下列分子或离子中不能与质子结合的是( )
| A. | F- | B. | H2O | C. | NH4+ | D. | NH3 |
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在密闭容器中充入1 mol N2和3 mol H2,充分反应后生成NH3的分子数目为2NA | |
| B. | 标准状况下,44.8 L氮气所含的共用电子对数目为2NA | |
| C. | 常温常压下,1 mol NaHSO4固体中含有的离子数目为2NA | |
| D. | 1 mol Fe与71 g Cl2充分反应后转移的电子数目为3NA |
12.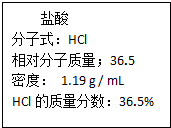 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(1)表中物质②的化学式为HClO4;③的电子式为 .
.
(2)①的稀溶液和⑥的溶液反应的离子方程式为:2H++SO32-═H2O+SO2↑.
(II)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为:11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配置500mL 物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸.
②实验中除合适的量筒、烧杯、玻璃棒外还需要的玻璃仪器有500mL容量瓶、胶头滴管.
③在配置过程中,下列实验操作对所配稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或无影响).
a.用量筒量取浓盐酸时俯视读数偏低.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水偏低.
(3)①假设该同学成功配置了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的氢氧
化钠溶液,该同学需取25mL盐酸.
②该同学用新配置的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,则可能
的原因是C.
A.盐酸挥发,浓度不足 B.配置过程中未洗涤烧杯和玻璃棒
C.配置溶液定容时,俯视容量瓶刻度线 D.加水超过刻度线,用胶头滴管吸出.
 (I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.
(I)表中①~⑥均是由Na、Mg、H、O、S、Cl等元素中的几种组成,根据物质的组成和性质将它们进行了分类.| 物质类别 | 含氧强酸 | 碱 | 钠盐 |
| 化学式 | ①H2SO4②HClO4 | ③ ④Mg(OH)2 ④Mg(OH)2 | ⑤NaCl ⑥Na2SO3 |
 .
.(2)①的稀溶液和⑥的溶液反应的离子方程式为:2H++SO32-═H2O+SO2↑.
(II)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为:11.9mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配置500mL 物质的量浓度为0.400mol/L的稀盐酸.
①该学生需要量取16.8mL上述浓盐酸.
②实验中除合适的量筒、烧杯、玻璃棒外还需要的玻璃仪器有500mL容量瓶、胶头滴管.
③在配置过程中,下列实验操作对所配稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或无影响).
a.用量筒量取浓盐酸时俯视读数偏低.
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水偏低.
(3)①假设该同学成功配置了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的氢氧
化钠溶液,该同学需取25mL盐酸.
②该同学用新配置的盐酸中和含0.4g NaOH的氢氧化钠溶液,发现实际所用体积偏小,则可能
的原因是C.
A.盐酸挥发,浓度不足 B.配置过程中未洗涤烧杯和玻璃棒
C.配置溶液定容时,俯视容量瓶刻度线 D.加水超过刻度线,用胶头滴管吸出.
16.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(B)=0.4mol/(L•min) | D. | v(A)=0.15mol/(L•s) |
13.下列变化属于物理变化的是( )
| A. | 分馏 | B. | 干馏 | C. | 裂化 | D. | 裂解 |
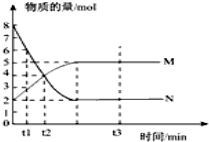 一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.
一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图示.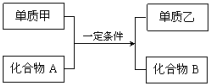 置换反应的通式可表示为:
置换反应的通式可表示为: