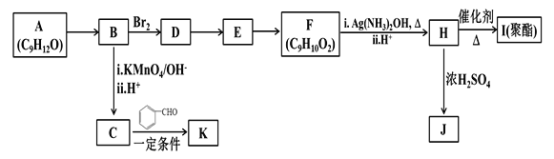
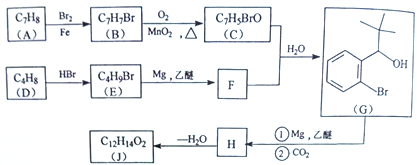
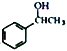
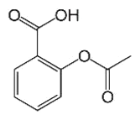
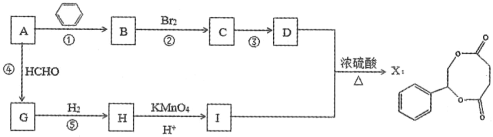
题目内容
【题目】将3 mol A和1 mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生如下反应:
3A(g)+B(g) ![]() 2C(g)+D(g),达到平衡时C的浓度为w mol/L。回答下列问题:
2C(g)+D(g),达到平衡时C的浓度为w mol/L。回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中有关物质,平衡后C的浓度仍为w mol/L的是_____。
A.6 mol A+2 mol B B.3 mol A+1 mol B+2 mol C
C.2 mol C+1 mol B+1 mol D D.1 mol C+2 mol D
(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为w mol/L,应按下列哪种配比向容器Q中充入有关物质_____。
A.3 mol A+1 mol B B.4 mol C+2 mol D
C.1.5 mol A+0.5 mol B+1 mol C+0.5 mol D D.无法判断
(3)保持原起始温度和体积不变,若仍按3 mol A和1 mol B配比在容器Q中发生反应,则平衡时C的浓度和w mol/L的关系是____。
A.大于w mol/L B.小于w mol/L C.等于w mol/L D.无法比较
(4)将2 mol C和2 mol D按起始温度和压强充入容器Q中,保持温度和体积不变,平衡时C的浓度为v mol/L,则v和w的关系是_____。
A.v>w B.v<w C.v=w D.无法比较
(5)维持原起始温度和体积不变,按下列哪种配比充入容器Q可使平衡时C的浓度为v mol/L ____。
A.1 mol C+0.5 mol D B.3 mol A+2 mol B
C.3 mol A+1 mol B+1 mol D D.以上均不能满足条件
【答案】A D B B C
【解析】
(1)在恒温等压条件下,两个平衡中C的浓度,说明两个反应为等效平衡,将投料“一边倒”后只要n(A):n(B)=3:1或n(C):n(D)=2:1,该反应一定与原反应互为等效平衡,平衡时C的浓度一定为w mol/L;
(5)该反应前后气体系数之和不相等,所以若要在恒温等体积的条件达到等效平衡,需要将物料“一边倒”之后有完全一样的投料。
(1)A.6molA+2molB,n(A):n(B)=6mol:2mol=3:1,所以该反应与原反应为等效平衡,平衡后C的浓度仍为w mol/L,故A正确;
B. 3molA+1molB+2molC,相当于加入了4molC、1molD,n(C):n(D)=4:1,两个反应不是等效平衡,所以达到平衡时C的浓度一定不是w mol/L,故B错误;
C.2molC+1molB+1molD,相当于加入了3molA、2molB,n(A):n(B)=3mol:2mol=3:2,该反应与原反应不是等效平衡,故C错误;
D.1molC+2molD,n(C):n(D)=1:2,与原平衡不是等效平衡,达到平衡时C的浓度不是w mol/L,故D错误;
故答案为:A;
(2)该反应为气体体积减小的反应,原容器P的体积可变,随着反应进行,容器体积缩小,相当于加压,而容器Q的体积不变,二者条件不一样,所以无法判断应如何充入起始反应组分;
故答案为D;
(3)容器Q体积不变,所以反应正向进行时容器内压强减小,P容器恒压,所以对于Q来说,容器P相当于缩小体积加压,加压会使该反应正向移动,C的浓度增大,所以容器Q中的平衡时C的浓度小于w mol/L;
故答案为B;
(4)2 mol C和1 mol D反应与3 mol A和1 mol B相当,根据(3)可知此时达到平衡时C的浓度小于w mol/L,再加1molD促使反应向左进行,C的浓度进一步减小,所以v<w;
故答案为:B;
(5)A.1 mol C+0.5 mol D与2 mol C和2mol D投料不同,故A不符合题意;
B.3 mol A+2 mol B相当于2molC+1molD+1molB,与2 mol C和2mol D投料不同,故B不符合题意;
C.3 mol A+1 mol B相当于2molC+1molD再加1molD即2 mol C和2mol D,投料相同,故C符合题意;
D.C选项符合题意,故D错误;
故答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】目前,“低碳经济”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题.
的产生及有效开发利用成为科学家研究的重要课题.
![]() 向浓
向浓![]() 溶液中通入
溶液中通入![]() 和
和![]() ,可以制得纳米级碳酸钙
,可以制得纳米级碳酸钙![]() 粒子直径在
粒子直径在![]() 之间
之间![]() ①向浓
①向浓![]() 溶液中通人
溶液中通人![]() 和
和![]() 气体制纳米级碳酸钙时,应先通入
气体制纳米级碳酸钙时,应先通入![]() ,后通入
,后通入![]() 制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
制备纳米级碳酸钙的离子方程式为 ______ ②判断产品中是否含有纳米级碳酸钙的实验方法为 ______ .
![]() 定条件下,
定条件下,![]() 和
和![]() 反应,能生成
反应,能生成![]() 和
和![]() 将
将![]() 和
和![]() 分别加入甲、乙两个密闭容器中,发生反应:
分别加入甲、乙两个密闭容器中,发生反应:![]() ,其相关数据如下表所示:
,其相关数据如下表所示:
容器 | 容积 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | |
|
|
| ||||
甲 | 2 |
| 2 | 4 |
| 8 |
乙 | 1 |
| 1 | 2 |
| 3 |
①![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______
______
②乙容器中,当反应进行到![]() 时,
时,![]() 的物质的量浓度 ______
的物质的量浓度 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]()
![]()
![]()
![]()
③丙容器的容积为1L,![]() 时,起始充入amol
时,起始充入amol![]() 和bmol
和bmol![]() ,反应达到平衡时,测得
,反应达到平衡时,测得![]() 的转化率大于
的转化率大于![]() 的转化率,则
的转化率,则![]() 的值需满足的条件为 ______ ;
的值需满足的条件为 ______ ;
④丁容器的容积为1L,![]() 时,按下列配比充入
时,按下列配比充入![]() 、
、![]() 、
、![]() 和
和![]() ,达到平衡时各气体的体积分数与甲容器完全相同的是 ______
,达到平衡时各气体的体积分数与甲容器完全相同的是 ______ ![]() 填选项字母
填选项字母![]() .
.
A.![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() 、
、![]() 、O
、O
C.![]() 、
、![]() 、
、![]() 、
、![]()
D.![]() 、
、![]() 、
、![]() 、
、![]()
![]() 在一定条件下可转化为甲醚
在一定条件下可转化为甲醚![]() 用甲醚燃料电池做电源,用惰性电极电解饱和
用甲醚燃料电池做电源,用惰性电极电解饱和![]() 溶液可制取
溶液可制取![]() 和KOH,实验装置如图所示
和KOH,实验装置如图所示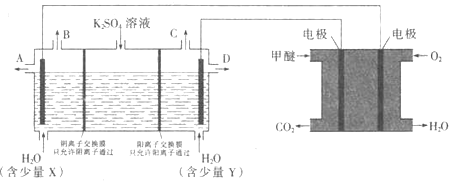
①甲醚燃料电池的负极反应式为 ______
②![]() 口导出的物质为 ______
口导出的物质为 ______ ![]() 填化学式
填化学式![]() .
.
③若燃料电池通入![]() 的速率为
的速率为![]() ,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
,2min时,理论上C口收集到标准状况下气体的体积为 ______ .
【题目】N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1温度下的部分实验数据如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 该反应在任何温度下均能自发进行
B. T1温度下的平衡常数为K1=125,1 000 s时N2O5(g)转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2