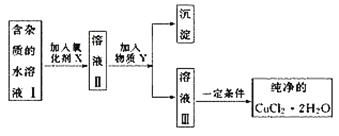
题目内容
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
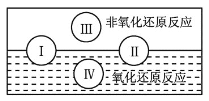
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”可用如图表达。试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_______,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
____CuO+____NH4Cl ![]() ____Cu+____CuCl2+____N2↑+____H2O
____Cu+____CuCl2+____N2↑+____H2O
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______(填元素名称),氧化剂是______(填化学式)。
③反应中若产生0.2mol的气体,则有________mol的电子转移。
(3)写出下列反应的离子方程式。
①NaHCO3溶于醋酸:____________________
②过量CO2与NaOH溶液反应:____________________
③Al(OH)3溶于NaOH溶液中:___________________
【答案】C+H2O(g) ![]() CO+H2或2Na+2H2O=2NaOH+H2↑ 氧化剂 4 2 3 1 1 4 N CuO 1.2mol HCO3-+CH3COOH=CH3COO-+CO2↑+H2O CO2+OH-= HCO3- Al(OH)3+OH-=AlO2-+2H2O
CO+H2或2Na+2H2O=2NaOH+H2↑ 氧化剂 4 2 3 1 1 4 N CuO 1.2mol HCO3-+CH3COOH=CH3COO-+CO2↑+H2O CO2+OH-= HCO3- Al(OH)3+OH-=AlO2-+2H2O
【解析】
(1)由图可知,反应类型Ⅳ全部属于氧化还原反应,应该是置换反应;
(2)①用化合价升降法配平化学方程式为4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O。
3Cu+CuCl2+N2↑+4H2O。
②在该反应中,氮元素化合价升高,被氧化,NH4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂;
③根据氧化还原反应中电子转移数目进行计算;
(3)①NaHCO3溶于醋酸生成醋酸钠、二氧化碳和水;
②过量CO2与NaOH溶液反应生成碳酸氢钠;
③Al(OH)3溶于NaOH溶液中,反应生成偏铝酸钠和水。
(1)由图可知,反应类型Ⅳ全部属于氧化还原反应,应该是置换反应,有水参加的置换反应有许多,如C+H2O(g) ![]() CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂;
CO+H2、2Na+2H2O=2NaOH+H2↑等上述两个反应中水均作氧化剂;
(2)①用化合价升降法配平化学方程式为4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O。
3Cu+CuCl2+N2↑+4H2O。
②在该反应中,氮元素化合价升高,被氧化,NH4Cl为还原剂,铜元素化合价降低,被还原,CuO为氧化剂;
故答案为:N;CuO;
③反应4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O中若产生0.2mol的气体,则有0.2mol ×3×2=1.2mol的电子转移;
3Cu+CuCl2+N2↑+4H2O中若产生0.2mol的气体,则有0.2mol ×3×2=1.2mol的电子转移;
(3)①NaHCO3溶于醋酸生成醋酸钠、二氧化碳和水,反应的离子方程式为HCO3-+CH3COOH=CH3COO-+CO2↑+H2O;
②过量CO2与NaOH溶液反应生成碳酸氢钠,反应的离子方程式为CO2+OH-= HCO3-;
③Al(OH)3溶于NaOH溶液中,反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。