题目内容
 甲醇是人们开发和利用的一种新能源.
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+
| 1 |
| 2 |
(1)甲醇蒸气完全燃烧的热化学反应方程式为
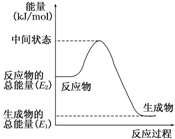
(2)反应②中的能量变化如图所示,则△H2=
(3)H2(g)的燃烧热为
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)依据反应焓变△H=生成物总能量-反应物总能量分析;
(3)依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式分析计算;
(4)根据氢能源的优点和氢能源的开发和利用的最新动向即可作答.
(2)依据反应焓变△H=生成物总能量-反应物总能量分析;
(3)依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式分析计算;
(4)根据氢能源的优点和氢能源的开发和利用的最新动向即可作答.
解答:
解:(1):①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,
②CH3OH(g)+
O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol,
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol.
故答案为:CH3OH(g)+
O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol;
(2)反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,故答案为:E1-E2;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9KJ/mol;
(4)地球上水资源丰富,可以从水中提取氢气,说明资源广泛;依据燃烧热计算分析,氢气的燃烧值高;因为氢气燃烧产物是水,不污染环境,
故答案为:来源广、热值高、不污染环境.
②CH3OH(g)+
| 1 |
| 2 |
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+
| 3 |
| 2 |
故答案为:CH3OH(g)+
| 3 |
| 2 |
(2)反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,故答案为:E1-E2;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9KJ/mol;
(4)地球上水资源丰富,可以从水中提取氢气,说明资源广泛;依据燃烧热计算分析,氢气的燃烧值高;因为氢气燃烧产物是水,不污染环境,
故答案为:来源广、热值高、不污染环境.
点评:本题考查了热化学方程式书写方法,燃烧热概念分析应用,化学反应与能量变化的计算关系,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
分子式为C5H11Br的一溴代烷水解后的产物在红热铜丝催化,最多可能被空气氧化生成的醛的种数是( )
| A、2种 | B、3种 | C、4种 | D、5种 |
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
下列反应中,属于水解反应且使溶液显酸性的是( )
| A、HSO3-+H2O═H3O++SO32- |
| B、HCO3-+H3O+═CO2↑+2H2O |
| C、S2-+H2O═HS-+OH- |
| D、NH4++H2O═NH3?H2O+H+ |
下列各组中的离子能在溶液中大量共存的是( )
| A、Na+、Ba2+、Cl-、CO32- |
| B、K+、H+、NO3-、HCO3- |
| C、Mg2+、H+、SO42-、NO3- |
| D、Na+、H+、Cl-、SiO32- |
在0.1mol/L CH3COONa溶液中,各离子的浓度关系正确的是( )
| A、c(CH3COO-)=0.1mol/L |
| B、c(OH-)=c(H+) |
| C、c(OH-)>c(H+) |
| D、c(OH-)<c(H+) |
 如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶.
如右图所示,某气体X可能由H2、CO、CH4中的一种或几种组成.将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶. 电解原理在化学工业中有广泛应用.如图表示一个电解池,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
电解原理在化学工业中有广泛应用.如图表示一个电解池,若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则