题目内容
利用图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 浓醋酸 | CaCO3 | C6H5ONa | 酸性:醋酸>碳酸>苯酚 | |
| B | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A、A | B、B | C、C | D、D |
分析:A.碳酸钙是难溶性物质,醋酸是弱酸且浓度越大其电离程度越小,导致醋酸和碳酸钙反应太慢,反应现象不明显;
B.溴易挥发,且溴和水反应生成氢溴酸;
C.工业电池中含有杂质,电石和水反应时除了生成乙炔外还生成其它还原性物质;
D.利用强酸制取弱酸的性质判断酸性强弱,非金属的最高价含氧酸的酸性越强,其非金属性越强.
B.溴易挥发,且溴和水反应生成氢溴酸;
C.工业电池中含有杂质,电石和水反应时除了生成乙炔外还生成其它还原性物质;
D.利用强酸制取弱酸的性质判断酸性强弱,非金属的最高价含氧酸的酸性越强,其非金属性越强.
解答:解:A.浓醋酸中氢离子浓度较小,碳酸钙是难溶性物质,导致浓醋酸和碳酸钙反应较缓慢,反应现象不明显,所以无法得出相应结论,故A错误;
B.溴易挥发,且溴和水反应生成氢溴酸,从而影响苯和溴反应生成的氢溴酸,所以无法得出相应结论,故B错误;
C.工业电石和水反应的产物中除了乙炔外还含有硫化氢等,乙炔和硫化氢都能使酸性高锰酸钾溶液褪色,所以无法得出相应结论,故C错误;
D.硫酸和碳酸钠反应生成碳酸,碳酸分解生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,所以酸性大小是:硫酸>碳酸>硅酸,非金属的最高价含氧酸的酸性越强,其非金属性越强,从而得出非金属性:S>C>Si,所以能得出正确结论,故D正确;
故选D.
B.溴易挥发,且溴和水反应生成氢溴酸,从而影响苯和溴反应生成的氢溴酸,所以无法得出相应结论,故B错误;
C.工业电石和水反应的产物中除了乙炔外还含有硫化氢等,乙炔和硫化氢都能使酸性高锰酸钾溶液褪色,所以无法得出相应结论,故C错误;
D.硫酸和碳酸钠反应生成碳酸,碳酸分解生成二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸,所以酸性大小是:硫酸>碳酸>硅酸,非金属的最高价含氧酸的酸性越强,其非金属性越强,从而得出非金属性:S>C>Si,所以能得出正确结论,故D正确;
故选D.
点评:本题考查实验现象及结论,涉及的知识点较综合,易错选项是A,注意醋酸浓度与氢离子浓度的关系,为易错点.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
| |||||||||||||||||||||||
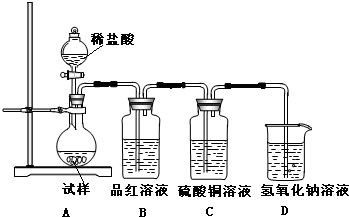 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: