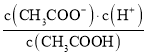题目内容
【题目】关于下列图像的叙述正确的是
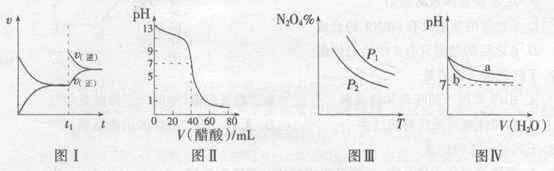
A.图I表示:反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
2HI(g) ΔH<0发热v-t关系,其中t1时刻改变的条件为升高温度
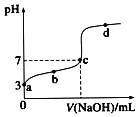
B.图Ⅱ表示:25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液的滴定曲线,其中c(CH3COOH)=0.1000mol/L
C.图Ⅲ表示:反应2NO2(g) ![]() N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
N2O4(g)的平衡体系中,N2O4的百分含量与温度(T)、压强(P)的变化关系,其中△H<0、P1<P2
D.图Ⅳ表示:25℃时,分别稀释等体积,等pH的NaOH溶液与氨水时的pH变化,其中曲线a对应氨水
【答案】D
【解析】
试题分析:A.I2(g)+H2(g) ![]() 2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。
2HI(g) 的反应是放热反应。升高温度,正、逆化学反应速率都加快。由于温度对吸热反应影响较大,所以根据平衡移动原理,化学平衡向吸热反应方向移动。所以逆反应速率增大的多。所以平衡向逆反应方向移动。错误。B.在25℃时,用醋酸溶液滴定40.00 mL 0.1000 mol·L-1NaOH溶液,当恰好完全反应时, n(NaOH)=n(CH3COOH) .但由于生成的CH3COONa是强碱弱酸盐,水解使溶液的pH>7。若使溶液的pH=7,则CH3COOH应该稍微过量。因此c(CH3COOH) >0.1000mol/L.错误。C.由图像可以看出:在压强不变时,升高温度,N2O4的含量降低。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以 该反应的正反应为放热反应。△H<0。在温度不变时,增大压强,平衡正向移动,N2O4的含量增大。所以p1>p2.错误。D. 25℃时,等pH的NaOH溶液与氨水,由于NaOH为强碱,完全电离,而NH3·H2O是弱碱,部分电离,因此c(NH3·H2O)>c(NaOH).当稀释相同的倍数时,由于NH3·H2O会继续电离产生OH-。因此溶液的pH变化较小。因此其中曲线a对应氨水。正确。

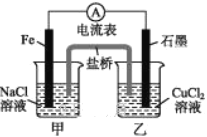
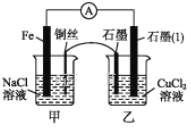
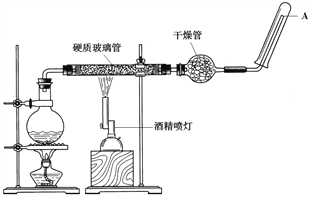
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
|
|
| 产生黄绿色气体 |
|
| 溶液变蓝 | |
|
| 溶液变红 | |
|
| 产生白色沉淀 | |
下列判断不正确的是![]()
![]()
A.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
B.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
C.实验![]() 中该条件下氧化性强弱
中该条件下氧化性强弱![]()
D.实验![]() 中
中![]() 与
与![]() 相互促进水解
相互促进水解