题目内容
某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
| A.△H<0,△S>0 | B.△H<0,△S<0 | C.△H>0,△S>0 | D.△H>0,△S<0 |
C
解析试题分析:化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T?△S<0时,反应能自发进行。当△H<0,△S>0时,△G=△H-T?△S<0,在室温一定能自发进行;而△H>0,△S<0时不能自发进行;当△H>0,△S>0时,在室温下不能自发进行,在高温下能自发进行;当△H<0,△S<0时,在室温下能自发进行,在高温下不能自发进行。因此如果某反应在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S均大于0,答案选C。
考点:考查反应自发性的判断

 阅读快车系列答案
阅读快车系列答案将0.5mol PCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
| A.80s | B.45s | C.30s | D.15s |
在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强;②增加炭的量;③通入CO2;④恒压下充入N2;⑤恒容下充入N2;⑥升温
①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
在一定温度下,向容积固定的密闭容器中充入amolC(g),发生如下可逆反应:2A(g)+B(g)  2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
| A.平均相对分子质量减小 | B. C的转化率增大 |
| C. C的质量分数增大 | D.反应热大于原来的2倍 |
反应P(g)+Q(g) M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡不移动 | B.加入催化剂,M的产率增大 |
| C.增大c(P),P的转化率增大 | D.降低温度,Q的转化率增大 |
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)  2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是
2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如图所示。下列说法中正确的是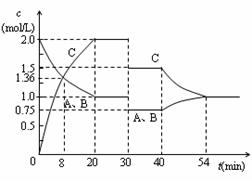
| A.30min时降低温度,40min时升高温度 |
| B.40min~54min之间反应速率v(正) < v(逆) |
| C.设20min和30min时的平衡常数分别为K1和K2,则K1 >K2 |
| D.0~8minA的平均反应速率为0.64mol/(L·min) |
下列图示与对应的叙述相符的是( )。
A.图1表示可逆反应 温度 温度 的情形 的情形 |
B.图2表示压强对可逆反应 的影响,乙的压强比甲的压强大 的影响,乙的压强比甲的压强大 |
| C.图3中a、b、c三点中只有b点已经达到化学平衡状态 |
| D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线 |
 xC(g)(正反应为放热反应)。测得两容器中C(A)随时间t的变化如图所示:下列说法正确的是 ( )
xC(g)(正反应为放热反应)。测得两容器中C(A)随时间t的变化如图所示:下列说法正确的是 ( )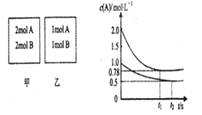
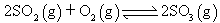
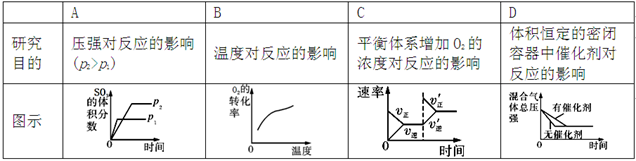
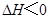 ,下列研究目的和示意图相符的是
,下列研究目的和示意图相符的是