题目内容
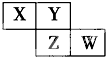 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、与H2化合,Z比W更容易 |
| D、形成的气态氢化物溶于水,溶液呈碱性的是:X |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X、Y为第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,根据其位置知X是N元素、Z是S元素、W是Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,越容易与H2化合;
D.X、Z、W气态氢化物分别是氨气、硫化氢、HCl,相同浓度的氢化物水溶液分别为碱性、弱酸性、强酸性.
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,越容易与H2化合;
D.X、Z、W气态氢化物分别是氨气、硫化氢、HCl,相同浓度的氢化物水溶液分别为碱性、弱酸性、强酸性.
解答:
解:X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X、Y为第二周期元素,Z和W属于第三周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y是O元素,根据其位置知X是N元素、Z是S元素、W是Cl元素,
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Z>W>X>Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性W>Z,所以其最高价氧化物的水化物酸性W>Z,故B错误;
C.元素的非金属性越强,越容易与H2化合,非金属性W>Z,所以W更容易与氢气化合,故C错误;
D.X、Z、W气态氢化物分别是氨气、硫化氢、HCl,相同浓度的氢化物水溶液,X、Z、W氢化物水溶液分别为碱性、弱酸性、强酸性,所以溶液呈碱性的是X,故D正确;
故选D.
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Z>W>X>Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性W>Z,所以其最高价氧化物的水化物酸性W>Z,故B错误;
C.元素的非金属性越强,越容易与H2化合,非金属性W>Z,所以W更容易与氢气化合,故C错误;
D.X、Z、W气态氢化物分别是氨气、硫化氢、HCl,相同浓度的氢化物水溶液,X、Z、W氢化物水溶液分别为碱性、弱酸性、强酸性,所以溶液呈碱性的是X,故D正确;
故选D.
点评:本题考查了元素周期表和元素周期律综合应用,灵活运用元素周期律知识解答即可,知道同一周期、同一主族元素性质变化规律,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列溶液中,与200mL 0.5mol/L Na2SO4溶液所含的Na+ 物质的量浓度相同的是( )
| A、200 mL 0.25 mol/L NaCl溶液 |
| B、200 mL 1 mol/L NaCl溶液 |
| C、100 mL 0.5 mol/L NaOH溶液 |
| D、100 mL 2 mol/L NaOH溶液 |
只给出如表甲和乙中对应的量,不能求出相应物质的物质的量的是( )
| ① | ② | ③ | ④ | |
| 甲 | 常温常压下气体的质量 | 气体分子数 | 固体体积 | 溶液中溶质质量分数 |
| 乙 | 气体相对分子质量 | 阿伏加德罗常数 | 固体密度 | 溶液的体积 |
| A、①② | B、③④ | C、②③ | D、①④ |
下列各组中的两种微粒互为同位素的是( )
| A、O2和O3 |
| B、1H2和2H2 |
| C、12C和13C |
| D、金刚石和石墨 |
分子式C4H8O2的有机物与硫酸溶液共热可得有机物A和B.将A氧化最终可得C,且B和C为同系物.若C可发生银镜反应,则原有机物的结构简式为( )
| A、CH3CH2COOCH3 |
| B、CH3COOCH2CH3 |
| C、HCOOCH2CH2CH3 |
| D、HCOOCH(CH3)2 |
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应属于区域2的是( )

| A、Zn+H2SO4=ZnSO4+H2↑ | ||||
B、H2+Cl2
| ||||
C、2KClO3
| ||||
| D、2Cl2+2Ca (OH)2=CaCl2+Ca(ClO)2+2H2O |
