题目内容
NH4Cl溶液的pH和稀盐酸的pH均为5,其中由水电离出的c(H+)分别为xmol·L-1和ymol·L-1。则下列x和y的关系正确的是()
| A.x=104y | B.x=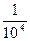 y y | C.x="y" | D.不能确定 |
A
 水解:
水解: +H2O
+H2O NH3·H2O+H+,破坏了水的电离平衡,使其电离程度增大,溶液显酸性,pH=5,x=c(H+)=10-5mol·L-1;而HCl溶液中水的电离遭到抑制,pH=5,c(H+)=10-5mol·L-1,y=c水(H+)=c水(OH-)=
NH3·H2O+H+,破坏了水的电离平衡,使其电离程度增大,溶液显酸性,pH=5,x=c(H+)=10-5mol·L-1;而HCl溶液中水的电离遭到抑制,pH=5,c(H+)=10-5mol·L-1,y=c水(H+)=c水(OH-)= mol·L-1=10-9mol·L-1,则有x=104y。故选A。
mol·L-1=10-9mol·L-1,则有x=104y。故选A。
练习册系列答案
相关题目
 Mg2++2OH- ①
Mg2++2OH- ① +H2O
+H2O +H2O
+H2O H3O++
H3O++ ,欲使溶液中c(
,欲使溶液中c( 以电离为主。在0.1mol·L-1的NaH2PO4溶液中,下列粒子浓度关系不正确的是()
以电离为主。在0.1mol·L-1的NaH2PO4溶液中,下列粒子浓度关系不正确的是() )+3c(PO
)+3c(PO )
)