题目内容
1.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
| A. | ①⑥⑦ | B. | ③⑧ | C. | ③⑦⑧ | D. | ⑦⑧ |
分析 为加快铁与盐酸的反应速率,可增大浓度,升高温度,形成原电池反应或增大固体的表面积,不改变生成氢气的总量,则铁的物质的量应不变,以此解答.
解答 解:①加水,稀释了盐酸的浓度,故反应速率变慢;
②加氢氧化钠,与盐酸反应,减少了盐酸的浓度,故反应速率变慢;
③加浓盐酸,反应速率加快;
④加醋酸钠固体与盐酸反应生成弱酸醋酸,故反应速率减慢;
⑤加氯化钠溶液,相当于稀释盐酸浓度,故反应速率变慢;
⑥滴加硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量;
⑦把反应器敞开放入100℃水浴中,虽然温度升高,但盐酸挥发,浓度降低,反应速率减小;
⑧改用浓度大的盐酸,反应速率加快.
故选B.
点评 本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,本题不改变生成氢气总量的要求,答题时注意审题,难度不大.

练习册系列答案
相关题目
11.下列有关实验原理、操作或现象不正确的是( )
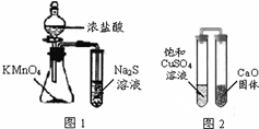

| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
12.下列物质属于碱性氧化物的是( )
| A. | SO3 | B. | CaO | C. | SO2 | D. | CO |
9.关于0.5molO2的下列说法正确的是( )
| A. | 体积为11.2L | B. | 摩尔质量是16g/mol | ||
| C. | 质量为32g | D. | 约含有6.02×1023个氧原子 |
16.下列说法不正确的是( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
6.铝、铍(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,下列说法正确的是( )
| A. | BeCl2水溶液导电性很强,故BeCl2是离子化合物 | |
| B. | Na2BeO2溶液PH>7,将其蒸干灼烧后得到固体BeO | |
| C. | 向Na2BeO2溶液中加入过量盐酸制备Be(OH)2 | |
| D. | Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-═BeO22-+2H2O |
10.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 | |
| B. | 1L lmol.L-1 FeBr2溶液与l mol氯气反应时转移的电子数为3NA | |
| C. | 标准状况下,11.2L HF所含的分子数约为3.01×1023 | |
| D. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA |
11.下列反应能用勒沙特列原理解释的是( )
| A. | 由SO2和O2反应制SO3需使用催化剂 | |
| B. | 燃烧粉碎的黄铁矿矿石有利于三氧化硫的生成 | |
| C. | 硫酸生产中用98.3%的硫酸吸收SO3,而不用水或稀硫酸吸收SO3 | |
| D. | 用氮气和氢气合成氨需采用高压 |