题目内容
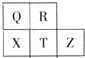
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是

A.R位于元素周期表中第二周期第IVA族
B.五种元素中原子半径最大的是X
C.气态氢化物稳定性:Y>T
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
【答案】
AB
【解析】
试题分析:根据元素周期表的相对位置,R与X同主族和T与Y同主族,结合它们的最外层电子数之和为24。设R的最外层电子为x,则2x+2x+2+x+2=24,x=4,可知R为C,X为Si,T为N,Y为P,Z为S。A、C位于元素周期表中第二周期第IVA族,A正确;B、同周期从左至右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,五种元素中原子半径最大的是X(Si),B正确;C、同主族从上到下,非金属逐渐减弱,金属性逐渐增强,非金属越强,气态氢化物的稳定性越强,气态氢化物稳定性:T>Y,C错误;D、Z元素的最高价氧化物对应的水化物的化学式为H2ZO4(H2SO4),D错误。
考点:考查元素周期表与元素周期律。

练习册系列答案
相关题目
 短周期元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
短周期元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )| A、五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强 | B、氢化物的稳定性:R>Q>X;R>T>X | C、Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 | D、X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、R位于元素周期表中第二周期第ⅣA族 |
| B、五种元素中原子半径最大的是X |
| C、气态氢化物稳定性:Y>T |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如表,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、X位于元素周期表中第三周期第ⅥA族 |
| B、Z元素的气态氢化物为极性分子 |
| C、Y元素最高价氧化物对应水化物为强酸 |
| D、五种元素中原子半径最大的是R |



