题目内容
某研究小组用如图所示装置探究SO2和Fe(NO3)3溶液反应的原理.
已知:1.0mol/LFe(NO3)3溶液的pH=1.请回答下列问题:
(1)装置A中发生反应的化学方程式是______.
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______.
(3)装置B中产生了白色沉淀,其成分是______,说明SO2具有性______.
(4)分析B中产生白色沉淀的原因:
假设1:______;
假设2:SO2与Fe3+反应;
假设3:SO2与酸性条件下的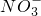 反应.
反应.
①按假设2,装置B中反应的离子方程式是______.
②按假设3,只需将装置B中的Fe(NO3)3溶液替换成等体积的下列溶液,在相同条件下进行实验.应选择的试剂是______(填序号).
a.0.1mol/L稀硝酸
b.1.5mol/L Fe(NO3)2溶液
c.6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液.
解:(l)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,
故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;
(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;
①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,
故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;
②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液代替,故选c.
分析:(1)亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(4)Fe3+和Fe2+都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断.
点评:本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.
故答案为:Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,故答案为:BaS04;还原性;
(4)假设一 两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3-都反应,故答案为:SO2和Fe3+、酸性条件下NO3-都反应;
①按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,
故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;
②按观点3,在酸性条件下SO2与NO3-反应,实验中c(NO3-)=3mol/L,则可用6.0mol?L-1NaNO3和0.2mol?L-1盐酸等体积混合的溶液代替,故选c.
分析:(1)亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(4)Fe3+和Fe2+都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断.
点评:本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式: 。
 (3)充分反应后,若A试管中有铜片剩余,继续向A中加入
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入
NaNO3,发现铜片溶解,反应的离子方程式
为 。
(4)充分反应后,若A试管中无铜片剩余,
但出现白色混浊,该白色固体是 ,
初步确认该白色固体是什么物质的实验操作方法
是 。
(5)B试管口的棉花应沾有的试剂是 。
(6)小组成员向(4)反应后的溶液中加入足量的氧化铜。使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量四次,最后两次称量的目的是
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.0g | 37.8g | 27.0g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”、“偏小”)。

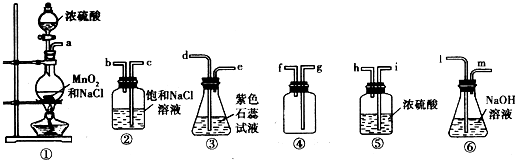
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.